6.接触法制硫酸排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前没法进行综合利用。
(1)某硫酸厂每天排放的10000立方米尾气中含有0.2%(体积百分数)的二氧化硫,问用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克石膏(CaSO4·2H2O)?
(2)如果将一定体积的尾气通入100毫升2摩/升的氢氧化钠溶液使其完全反应,经测定所得溶液含有16.7克溶质。试分析该溶液的成分,并计算确定各成分的物质的量。
(3)工厂在尾气处理制石膏的过程中,中间产物是亚硫酸氢钠。调节尾气排放的流量,以取得二氧化硫与氢氧化钠间物质的量最佳比值,从而提高亚硫酸氢钠的产量。现设n(SO2)、n(NaOH)、n(NaHSO3)分别表示二氧化硫、氢氧化钠和亚硫酸氢钠的物质的量,且 =x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式(不要求全部填满)。
=x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式(不要求全部填满)。
|
x |
n(NaHSO3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
[提示]:对于(2),先确定反应的产物是NaHSO3与Na2SO3的混和物,设这两种物质的物质的量分别是x、y,可列出下式:
 对于(3)可以运用分段讨论法,根据发生的反应,可确定
对于(3)可以运用分段讨论法,根据发生的反应,可确定 、
、 两个分界点,从而产生x£1、
两个分界点,从而产生x£1、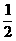 <x<1、x³1三个区域,然后再进一步讨论,最后可得:
<x<1、x³1三个区域,然后再进一步讨论,最后可得:
|
x |
n(NaHSO3) |
x£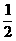 |
0 |
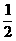 <x<1 <x<1 |
2n(SO2)-n(NaOH) |
|
x³1 |
n(NaOH) |
 ,所以生成物中既有单质S,又有SO2存在。
[解一]:正向推导法
假如先发生反应①,则50毫升H2S中的S全部转变成单质S,同时消耗O225毫升,剩余的35毫升O2再与部分S发生反应S+O2 =
SO2,显然,当O2消耗完时,生成SO2的体积为35毫升。
[解二]:逆向推导法
假定先发生反应②,60毫升O2消耗完时可生成SO240毫升,同时消耗H2S40毫升,剩余10毫升H2S再与部分SO2发生反应2H2S+SO2
= 3S+2H2O,显然,该反应又消耗SO25毫升,则最后得到的SO2体积=40-5=35毫升。
[解三]:列方程组法
设发生反应①的H2Sx毫升,发生反应②的H2S为y毫升,据题意有:
,所以生成物中既有单质S,又有SO2存在。
[解一]:正向推导法
假如先发生反应①,则50毫升H2S中的S全部转变成单质S,同时消耗O225毫升,剩余的35毫升O2再与部分S发生反应S+O2 =
SO2,显然,当O2消耗完时,生成SO2的体积为35毫升。
[解二]:逆向推导法
假定先发生反应②,60毫升O2消耗完时可生成SO240毫升,同时消耗H2S40毫升,剩余10毫升H2S再与部分SO2发生反应2H2S+SO2
= 3S+2H2O,显然,该反应又消耗SO25毫升,则最后得到的SO2体积=40-5=35毫升。
[解三]:列方程组法
设发生反应①的H2Sx毫升,发生反应②的H2S为y毫升,据题意有:
 解得
解得 35毫升H2S按②式反应得到SO2的体积肯定是35毫升。
[解四]:直接配平法
分析题意可知,在反应过程中,H2S与O2两者均完全消耗完,所以可以用直接配平法进行解题:
50H2S+60O2
= 15S+35SO2+50H2O
上式表明:该反应中生成的SO2的体积为35毫升。
[解五]:差量法
H2S与O2反应生成液态水,无论发生反应①还是发生反应②,气体总体积的减少都是原H2S体积的
35毫升H2S按②式反应得到SO2的体积肯定是35毫升。
[解四]:直接配平法
分析题意可知,在反应过程中,H2S与O2两者均完全消耗完,所以可以用直接配平法进行解题:
50H2S+60O2
= 15S+35SO2+50H2O
上式表明:该反应中生成的SO2的体积为35毫升。
[解五]:差量法
H2S与O2反应生成液态水,无论发生反应①还是发生反应②,气体总体积的减少都是原H2S体积的 倍,本题中即减少50×
倍,本题中即减少50×
 ,故发生反应②的H2S为50×
,故发生反应②的H2S为50× =35毫升,可知生成SO2的体积为35毫升。
[解七]:以50毫升H2S燃烧为基础作图:当O2为25毫升时开始生成SO2,当O2为75毫升时生成 SO2达到最大值(50毫升),从y轴中找到与x轴的“60”该值相对应的值是35,这说明生成SO2的体积为35毫升。
=35毫升,可知生成SO2的体积为35毫升。
[解七]:以50毫升H2S燃烧为基础作图:当O2为25毫升时开始生成SO2,当O2为75毫升时生成 SO2达到最大值(50毫升),从y轴中找到与x轴的“60”该值相对应的值是35,这说明生成SO2的体积为35毫升。


 <28.6%
<28.6% >28.6%
>28.6% S+
S+ SO2+1H2O
SO2+1H2O 解得:a=1.8
解得:a=1.8 =57.2%
=57.2% 2ZnO+2SO2 2C+O2
2ZnO+2SO2 2C+O2 试回答下列问题:
(1)软锰矿、闪锌矿粉未与硫酸溶液共热时析出硫的反应为氧化-还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S¯+2H2O,据此写出MnO2在酸性溶液中分别和CuS、FeS和CdS发生氧化-还原反应的化学方程式:
[答]:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S¯+2H2O
MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S¯+6H2O
CdS+3H2SO4+MnO2=MnSO4+CdSO4+S¯+2H2O
软锰矿中Al2O3溶于硫酸的离子方程式:
[答]:Al2O3+6H+=2Al3++3H2O
(2)用离子方程式表示浸出液A与适量Zn粉作用得到滤液B与滤渣乙的过程
[答]:Zn+Cu2+=Cu+Zn2+ Zn+Cd2+=Cd+Zn2+ Zn+2Fe3+=2Fe2++Zn2+
(3)产品C的化学式是[答:H2SO4]
(4)试从环境保护和能量消耗的角度评价90年代新工艺相比较有哪些优点。
[答]:从环境保护角度评价:无SO2对大气的污染;从能量消耗角度评价:无高温焙烧热污染,不需要高温焙烧节约燃料。
试回答下列问题:
(1)软锰矿、闪锌矿粉未与硫酸溶液共热时析出硫的反应为氧化-还原反应,例如:MnO2+ZnS+2H2SO4=MnSO4+ZnSO4+S¯+2H2O,据此写出MnO2在酸性溶液中分别和CuS、FeS和CdS发生氧化-还原反应的化学方程式:
[答]:MnO2+CuS+2H2SO4=MnSO4+CuSO4+S¯+2H2O
MnO2+2FeS+6H2SO4=Fe2(SO4)3+3MnSO4+2S¯+6H2O
CdS+3H2SO4+MnO2=MnSO4+CdSO4+S¯+2H2O
软锰矿中Al2O3溶于硫酸的离子方程式:
[答]:Al2O3+6H+=2Al3++3H2O
(2)用离子方程式表示浸出液A与适量Zn粉作用得到滤液B与滤渣乙的过程
[答]:Zn+Cu2+=Cu+Zn2+ Zn+Cd2+=Cd+Zn2+ Zn+2Fe3+=2Fe2++Zn2+
(3)产品C的化学式是[答:H2SO4]
(4)试从环境保护和能量消耗的角度评价90年代新工艺相比较有哪些优点。
[答]:从环境保护角度评价:无SO2对大气的污染;从能量消耗角度评价:无高温焙烧热污染,不需要高温焙烧节约燃料。 ];反应后生成SO2和H2O(气)的物质的量之和为[答:1+
];反应后生成SO2和H2O(气)的物质的量之和为[答:1+ ]摩。
[提示]:可采用直接配平法:
aH2S+O2=
]摩。
[提示]:可采用直接配平法:
aH2S+O2= SO2+
SO2+ S+aH2O
可见n(SO2)+n(H2O)=
S+aH2O
可见n(SO2)+n(H2O)=