0 32261 32269 32275 32279 32285 32287 32291 32297 32299 32305 32311 32315 32317 32321 32327 32329 32335 32339 32341 32345 32347 32351 32353 32355 32356 32357 32359 32360 32361 32363 32365 32369 32371 32375 32377 32381 32387 32389 32395 32399 32401 32405 32411 32417 32419 32425 32429 32431 32437 32441 32447 32455 447348
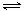 H++A2- 回答下列问题:
H++A2- 回答下列问题: NH3·H2O + H+
NH3·H2O + H+