21.(12分)
10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
|
温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
|
pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式: 。
乙同学类比加热Ca(HCO3)2溶液,会出现 现象,认为NaHCO3溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断水解程度:
Na2CO3 NaHCO3(填“大于”或“小于”)
丙同学认为甲、乙的判断都不充分。丙认为:
⑴ 只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则说明 (填“甲”或“乙”)判断正确。
试剂X是______________(填字母)
A. Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
⑵ 将加热后的溶液冷却到10℃,若溶液的pH (填“高于”、“低于”或“等于”)8.3,则说明另一判断正确。
19.(12分)下表是不同温度下水的离子积数据:
|
温度/℃ |
25 |
t1 |
t2 |
|
水的离子积 (mol2·L-2 ) |
1×10-14 |
a |
1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a 1×10-14 (填“>”、“<”或“=”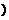 ,作此判断的理由是 。
,作此判断的理由是 。
(2)25℃下,某Na2SO4溶液中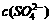 = 5×10-4mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+) : c(OH-)=
。
= 5×10-4mol·L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+) : c(OH-)=
。
(3)在t2 ℃下,pH = 10的NaOH溶液中,水电离产生的OH-浓度为
c(OH-)水= 。
(4)t2 ℃下,将pH = 11的苛性钠溶液V1L与pH = 1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH = 2,则V1∶V2 = ,
此溶液中各种离子的浓度由大到小的排列顺序:
。
 N2O4(g) ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g) ΔH= -52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验: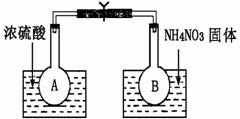 (1)观察到的实验现象为:
(1)观察到的实验现象为: (10分)电化学与生产生活密切相关。
(10分)电化学与生产生活密切相关。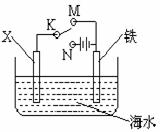 (2)利用下图装置模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于
处(填M或N);
(2)利用下图装置模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于
处(填M或N);