摘要:19.下表是不同温度下水的离子积数据: 温度/℃ 25 t1 t2 水的离子积 (mol2·L-2 ) 1×10-14 a 1×10-12 试回答以下问题: (1)若25<t1<t2.则a 1×10-14 (填“> .“< 或“= .作此判断的理由是 . (2)25℃下.某Na2SO4溶液中= 5×10-4mol·L-1.取该溶液1mL加水稀释至10mL.则稀释后溶液中c(Na+) : c(OH-)= . (3)在t2 ℃下.pH = 10的NaOH溶液中.水电离产生的OH-浓度为 c(OH-)水= . (4)t2 ℃下.将pH = 11的苛性钠溶液V1L与pH = 1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和).所得混合溶液的pH = 2.则V1∶V2 = . 此溶液中各种离子的浓度由大到小的排列顺序: .
网址:http://m.1010jiajiao.com/timu3_id_320823[举报]
下表是不同温度下水的离子积数据:
试回答以下问题:
(1)若25<t1<t2,则α
(2)25℃下,某Na2SO4溶液中c(SO42- )=5×10-4 mol?L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c(Na+):c(SO42- )=
(3)10mLpH=4的盐酸,稀释10倍到100mL时,pH=
(4)常温下,pH=5和pH=3的盐酸溶液等体积混合后溶液的pH=
(5)将t2℃温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
①若所得混合溶液为中性,则a:b=
查看习题详情和答案>>
| 温度(℃) | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-13 |
(1)若25<t1<t2,则α
>
>
(填“<”“>”或“=”)1×10-14,作出此判断的理由是升高温度,水的电离程度增大,离子积增大
升高温度,水的电离程度增大,离子积增大
.(2)25℃下,某Na2SO4溶液中c(SO42- )=5×10-4 mol?L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c(Na+):c(SO42- )=
2:1
2:1
; c(Na+):c(OH-)=1000:1
1000:1
.(3)10mLpH=4的盐酸,稀释10倍到100mL时,pH=
5
5
.(4)常温下,pH=5和pH=3的盐酸溶液等体积混合后溶液的pH=
3.3
3.3
.(5)将t2℃温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,
①若所得混合溶液为中性,则a:b=
10:1
10:1
;②若所得混合溶液pH=2,则a:b=9:2
9:2
.(以上均忽略溶液混合前后体积的变化)下表是不同温度下水的离子积数据:
试回答以下几个问题:
(1)若25<t1<t2,则a
(2)在t1℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为:
(3)在t2℃下,将pH=11的苛性钠溶液V1L与pH=1的硫酸溶液V2L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=2,则V1:V2=
查看习题详情和答案>>
| 温度/℃ | 25 | t1 | t2 |
| Kw/mol2?L-2 | 1×10-14 | a | 1×10-12 |
(1)若25<t1<t2,则a
>
>
1×10-14(填“<”、“>”或“=”),由此判断的理由是:升高温度,水的电离程度增大,离子积增大
升高温度,水的电离程度增大,离子积增大
.(2)在t1℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为:
1×10-10 mol?L-1
1×10-10 mol?L-1
.(3)在t2℃下,将pH=11的苛性钠溶液V1L与pH=1的硫酸溶液V2L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=2,则V1:V2=
9:11
9:11
,此溶液中各种离子的浓度由大到小的顺序是c(Na+)>c(SO42-)>c(H+)>c(OH-)
c(Na+)>c(SO42-)>c(H+)>c(OH-)
.(14分)下表是不同温度下水的离子积数据:
| 温度/℃ | 25 | t1 | t2 |
| Kw/ mol2·L-2 | 1×10-14 | a | 1×10-12 |
试回答以下几个问题:
(1)若25< t1< t2,则a 1×10-14(填“<”、“>”或“=”),由此判断的理由是: 。
(2)在t1℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为: 。
(3)在t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的硫酸溶液V2 L混合(设混合后溶液体积为原两溶液体积之和)所得溶液的pH=2,则V1︰V2 = ,此溶液中各种离子的浓度由大到小的顺序是 。
查看习题详情和答案>>
(14分)下表是不同温度下水的离子积数据:
| 温度/℃ | 25 | t1 | t2 |
| Kw/ mol2·L-2 | 1×10-14 | a | 1×10-12 |
试回答以下几个问题:
(1)若25<t1< t2,则a 1×10-14(填“<”、“>”或“=”),由此判断的理由是:
(2)在25℃下,pH=10的NaOH溶液中,水电离产生的[OH-]为:
(3)若某温度下,纯水中c(H+) = 5×10-7 mol·L-1,则此时纯水中的c(OH-) =_______________;若温度不变,滴入稀硫酸使c(H+)=5.0×10-3 mol·L-1,则c(OH-) =_______________。
查看习题详情和答案>>
(12分)下表是不同温度下水的离子积数据:
| 温度 / ℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
(1)若25<t1<t2,则α________1×10-14(填“>”“<”或“=”),作出此判断的理由是________________________________________________________。
(2)已知25℃时饱和NaHCO3溶液的PH>7,则此温度下饱和NaHCO3溶液中各离子浓度关
系正确的是______________
A.c(Na+)>c(HCO
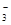 )>c(OH-)>c(H+)>c(CO
)>c(OH-)>c(H+)>c(CO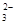 )
) B.c(Na+)+c(H+)=c(HCO
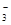 )+c(CO
)+c(CO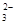 )+c(OH-)
)+c(OH-)C.c(Na+)=c(HCO
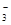 )+c(CO
)+c(CO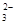 )+c(H2CO3)
)+c(H2CO3)D.c(OH-)=c(HCO
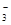 )+c(H2CO3)+c(H+)
)+c(H2CO3)+c(H+)(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=___________。此溶液中各种离子的浓度由大到小的排列顺序是____________________。 查看习题详情和答案>>