摘要:1.下列物质溶于水中.存在电离平衡 A.NaOH B.Na2CO3 C.H2SO4 D.CH3COOH
网址:http://m.1010jiajiao.com/timu3_id_320826[举报]
某校科技活动小组用镁粉、盐酸、醋酸设计以下实验,对两种酸分别与镁反应的速率和电离平衡理论进行研究,设计的实验装置如图所示(夹持固定装置已略去).
正确操作,记录得到下图2中部分实验数据.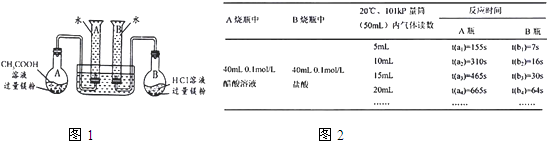
分析数据,观察实验装置图,回答下列问题:
(1)组装完成后,某同学发现该装置在设计上存在明显缺陷:根本无法完成实验,甚至存在危险,其缺陷在于
经小组研究后,稍作改进就可继续实验了;
(2)欲配置100mL实验所需浓度的盐酸,除烧杯、酸式滴定管、胶头滴管之外,还需用到的主要玻璃仪器是
(3)在实验数据中
①t(a1)远远大于t(b1)的原因为:
②由
(4)该实验得到什么结论?(回答出两点即可)
①
②
(5)通过实验判断,锌与稀盐酸制氢气时,若要减慢反应速率而不影响产生氢气的量,可以加入
查看习题详情和答案>>
正确操作,记录得到下图2中部分实验数据.

分析数据,观察实验装置图,回答下列问题:
(1)组装完成后,某同学发现该装置在设计上存在明显缺陷:根本无法完成实验,甚至存在危险,其缺陷在于
量筒口胶塞的使用,使得反应产生的H2无法进入量筒(当反应开始之后,会造成烧瓶或量筒的胶塞被气体强力推出而发生危险)
量筒口胶塞的使用,使得反应产生的H2无法进入量筒(当反应开始之后,会造成烧瓶或量筒的胶塞被气体强力推出而发生危险)
;经小组研究后,稍作改进就可继续实验了;
(2)欲配置100mL实验所需浓度的盐酸,除烧杯、酸式滴定管、胶头滴管之外,还需用到的主要玻璃仪器是
容量瓶(100mL)、玻璃棒
容量瓶(100mL)、玻璃棒
;(3)在实验数据中
①t(a1)远远大于t(b1)的原因为:
开始阶段醋酸溶液中的c(H+)远小于相同浓度的盐酸中的c(H+)
开始阶段醋酸溶液中的c(H+)远小于相同浓度的盐酸中的c(H+)
;②由
t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
[用含t(b1)、t(b2)、t(b3)代数式表示]说明盐酸是强酸,不存在电离平衡;由t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
[用含t(a1)、t(a2)、t(a3)代数式表示]说明醋酸中存在电离平衡.(4)该实验得到什么结论?(回答出两点即可)
①
相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大(过一段时间,醋酸与镁反应速率较盐酸的快)
相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大(过一段时间,醋酸与镁反应速率较盐酸的快)
;②
盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
.(5)通过实验判断,锌与稀盐酸制氢气时,若要减慢反应速率而不影响产生氢气的量,可以加入
CH3COONa固体、水或NaCl溶液
CH3COONa固体、水或NaCl溶液
(填写两种不同作用原理的物质).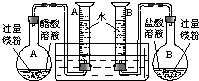 (2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.
(2009?肇庆二模)某校科技活动小组用镁粉、盐酸、醋酸及设计的右图装置(夹持固定装置已略去),对两种酸分别与镁反应的速率以及是否存在电离平衡进行探究.(1)组装完成后,某同学发现该装置在设计上存在明显缺陷:根本无法完成实验,甚至存在危险,其缺陷在于
A、B两个量筒口用胶塞密封,反应产生的H2会造成压强过大而发生危险[或密封的量筒内气压随反应开始后不断增大,会造成烧瓶或量筒因压强过大将胶塞推出]
A、B两个量筒口用胶塞密封,反应产生的H2会造成压强过大而发生危险[或密封的量筒内气压随反应开始后不断增大,会造成烧瓶或量筒因压强过大将胶塞推出]
,其改进方法是除去A、B量筒口的胶塞
除去A、B量筒口的胶塞
.(2)改进装置后,检查一侧装置的气密性的方法是
将导管口放入水槽中,用手捂住烧瓶,如果导管口有气泡产生,松开手后导管内有一段水柱,证明装置不漏气
将导管口放入水槽中,用手捂住烧瓶,如果导管口有气泡产生,松开手后导管内有一段水柱,证明装置不漏气
.(3)欲配制100mL实验所需浓度的盐酸,除50mL量筒、烧杯、酸式滴定管、胶头滴管之外,还需用到的主要玻璃仪器是
100mL容量瓶、玻璃棒
100mL容量瓶、玻璃棒
.正确操作,记录得到下表中部分实验数据.分析数据,观察实验装置图,回答下列问题:
| A烧瓶中 | B烧瓶中 | 20℃、101kPa 50mL量筒内气体读数 |
反应时间 | |
| A瓶 | B瓶 | |||
| 40mL0.1mol/L 醋酸溶液 |
40mL0.1mol/L 盐酸溶液 |
5mL | t(a1)=155s | t(b1)=7s |
| 10mL | t(a2)=310s | t(b2)=16s | ||
| 15mL | t(a3)=465s | t(b3)=30s | ||
| 20mL | t(a4)=565s | t(b4)=64s | ||
| … | … | … | ||
| 44.8mL | t(an)=865s | t(bn)=464s | ||
开始阶段醋酸溶液中的[H+]远小于相同浓度的盐酸中的[H+]
开始阶段醋酸溶液中的[H+]远小于相同浓度的盐酸中的[H+]
;②由
t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
t(b3)-t(b2)>t(b2)-t(b1)或t(b3)>t(b1)+t(b2)
[用含t(b1)、t(b2)、t(b3)代数式表示]说明盐酸是可能不存在电离平衡;由t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
t(a3)-t(a2)=t(a2)-t(a1)或t(a3)=t(a1)+t(a2)
[用含t(a1)、t(a2)、t(a3)代数式表示]说明醋酸中存在电离平衡.(5)通过该实验可得到的结论是(回答出两点即可):①
相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大,过一段时间后醋酸较盐酸反应速率的快
相同物质的量浓度的盐酸、醋酸与金属反应时,盐酸开始反应速率大,过一段时间后醋酸较盐酸反应速率的快
;②盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
盐酸是强电解质,醋酸是弱电解质(存在电离平衡)
. 碳是形成化合物最多的元素.
碳是形成化合物最多的元素.(1)由碳元素参与形成的物质多为分子晶体,也有少数原子晶体.下列关于分子晶体和原子晶体的说法正确的是
A、完全由非金属元素形成的物质一定是分子晶体或原子晶体
B、分子晶体中分子之间一定存在范德华力
C、SiC具有极高的熔点和较大的硬度,SiC分子中除存在共价键外,还存在分子间作用力
D、金刚石是由碳元素形成的原子晶体,性质稳定,不与任何物质反应
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子.C4分子结构如图所示.下列说法正确的是
A、C4属于一种新型的化合物 B、C4与P4(白磷)的晶体都属于分子晶体
C、C4气体分子内含有极性共价键 D、C4与C60互为同素异形
(3)与碳同主族元素锗为32号元素,与锗同周期,且未成对电子数与锗相同,电负性最大的元素的价电子排布式为
(4)邻硝基苯酚的熔点
(5)硼、碳、氮、氧是元素周期表第二周期相邻的四种元素.下列有关的四种化合
物中,键角最小的是
A、CO2 B、CF4 C、NF3 D、OF2
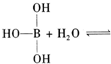
已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸,可以用硼酸在水溶液中的电离平衡解释它是一元弱酸的原因.
请写出下面这个方程式右端的两种离子的表达式:
 查看习题详情和答案>>
查看习题详情和答案>>
氯碱工业中电解饱和食盐水的原理示意图如图所示:
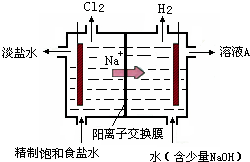
(1)由于生成的氯气可溶于水,并发生下列反应Cl2+H2O?HCl+HClO,电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用
(2)电解所用的盐水需精制.去除食盐水中含有的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)].精致流程如下(淡盐水和溶液A来上述电解池):
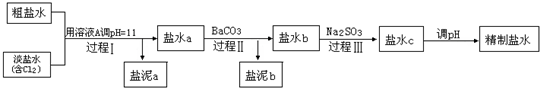
①盐泥a除泥沙外,还含有的物质是
②过程Ⅰ中Cl2将NH4+转化为N2的离子方程式是
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有
④经过程Ⅲ处理,要求盐水c中剩余Na2SO3的含量小于5mg/L,若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b,最多添加10%Na2SO3溶液的质量为多少kg?(加入溶液引起的体积变化忽略不计,请写出解题步骤).
查看习题详情和答案>>

(1)由于生成的氯气可溶于水,并发生下列反应Cl2+H2O?HCl+HClO,电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用
氯气在水中存在平衡为Cl2+H2O?HCl+HClO,增大盐酸的浓度可使该平衡向逆反应方向移动,减少氯气在水中的溶解,有利于氯气的逸出
氯气在水中存在平衡为Cl2+H2O?HCl+HClO,增大盐酸的浓度可使该平衡向逆反应方向移动,减少氯气在水中的溶解,有利于氯气的逸出
;(2)电解所用的盐水需精制.去除食盐水中含有的Ca2+、Mg2+、NH4+、SO42-[c(SO42-)>c(Ca2+)].精致流程如下(淡盐水和溶液A来上述电解池):

①盐泥a除泥沙外,还含有的物质是
Mg(OH)2
Mg(OH)2
.②过程Ⅰ中Cl2将NH4+转化为N2的离子方程式是
2NH4++3Cl2+8OH-=N2+6Cl-+8H2O或2NH4++3ClO-+2OH-=N2+3Cl-+5H2O
2NH4++3Cl2+8OH-=N2+6Cl-+8H2O或2NH4++3ClO-+2OH-=N2+3Cl-+5H2O
.③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有
Ca2+、SO42-
Ca2+、SO42-
.④经过程Ⅲ处理,要求盐水c中剩余Na2SO3的含量小于5mg/L,若盐水b中NaClO的含量是7.45mg/L,则处理10m3盐水b,最多添加10%Na2SO3溶液的质量为多少kg?(加入溶液引起的体积变化忽略不计,请写出解题步骤).
1.76kg
1.76kg
.碳是形成化合物最多的元素。
(1)由碳元素参与形成的物质多为分子晶体,也有少数原子晶体。下列关于分子晶体和原子晶体的说法正确的是 (填字母序号)。
A、完全由非金属元素形成的物质一定是分子晶体或原子晶体
B、分子晶体中分子之间一定存在范德华力
C、SiC具有极高的熔点和较大的硬度,SiC分子中除存在共价键外,还存在分子间作用力
D、金刚石是由碳元素形成的原子晶体,性质稳定,不与任何物质反应
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如图所示。下列说法正确的是 。
A、C4属于一种新型的化合物 B、C4与P4(白磷)的晶体都属于分子晶体
C、C4气体分子内含有极性共价键 D、C4与C60互为同素异形
(3)与碳同主族元素锗为32号元素,与锗同周期,且未成对电子数与锗相同,电负性最大的元素的价电子排布式为 。
(4)邻硝基苯酚的熔点 对硝基苯酚(填“>”、“=”或“<”=)。
(5)硼、碳、氮、氧是元素周期表第二周期相邻的四种元素。下列有关的四种化合物中,键角最小的是 。
A、CO2 B、CF4 C、NF3 D、OF2
已知硼酸H3BO3为白色固体,溶于水显弱酸性,但它却是一元酸,可以用硼酸在水溶液中的电离平衡解释它是一元弱酸的原因。
请写出下面这个方程式右端的两种离子的表达式: 。
。