30.某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
I、实验方案
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应。
(1)用pH试纸测定NaOH溶液pH时,正确的操作是: ▲ 。
(2)简述强调“测得的pH小于7”的理由: ▲ 。
方案二:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
该组同学将不同浓度的盐酸和NaOH溶液各10 克混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
|
编号 |
盐酸 |
NaOH溶液 |
△t/℃ |
|
1 |
3.65﹪ |
2.00﹪ |
3.5 |
|
2 |
3.65﹪ |
4.00﹪ |
x |
|
3 |
7.30﹪ |
8.00﹪ |
14 |
(1)表中x = ▲ 。
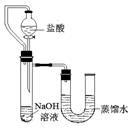
(2)某同学在没使用温度计的情况下,通过右图所示装置完成了实验。则该同学根据 ▲
判断NaOH溶液与稀盐酸发生了中和反应。
II、实验中的意外情况
在实验过程中,他们发现盛放NaOH溶液的试剂瓶瓶口和橡皮塞上出现了白色粉末。他们依据所学的化学知识,对这种白色粉末的成分作了如下猜想:① 可能是NaOH;② 可能是Na2CO3; ③ 可能是NaOH和Na2CO3。
(1)小明同学取白色粉末少许,溶于水后,先向溶液中加入足量的 ▲ 溶液,看到白色沉淀产生,然后向上层清液中加入酚酞试液,看到溶液呈红色,验证了猜想③是正确的。
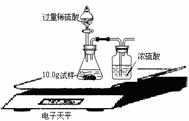 (2)为了进一步研究,三位同学取了10.0g上述样品,利用电子天平共同做了下图所示的实验。
(2)为了进一步研究,三位同学取了10.0g上述样品,利用电子天平共同做了下图所示的实验。

实验数据记录如下:
|
称
量 项 目 |
称
量 时 间 |
质量(g) |
|
试样 |
|
10.00 |
|
装置+稀硫酸质量 |
|
241.20 |
|
装置+稀硫酸质量+试样 |
反应开始后15秒 |
249.20 |
|
装置+稀硫酸质量+试样 |
反应开始后35秒 |
249.00 |
|
装置+稀硫酸质量+试样 |
反应开始后55秒 |
249.00 |
试通过分析表中数据计算上述样品中各成份的质量分数(写出计算过程)。 ▲
(3)有同学提出按上述实验所测得试样中Na2CO3质量分数会偏小,该同学的理由是(实验操作均正确): ▲ 。
2010-2011学年度初三第一次学业水平调研测试
28. (4分)金属活动性顺序在工农业生产和科学研究中有重要应用。现有一化学兴趣小组为探究铁、铜、锌、银的金属活动顺序,设计了如下图所示的三个实验(其中金属均已用砂纸打磨过,其形状、大小及同种稀盐酸的用量均相同):
(1)一段时间后,观察到实验B的铜片表面有银白色固体附着,这说明铜比银的活动性
▲ (选填“强”或“弱”)

|
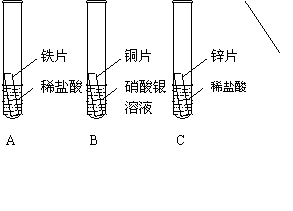




 ①要比较产生气体的快慢,可以测量相同时间内产生气体的体积,也可以测量 ▲ 。通过有关实验数据,乙得出了锌比铁的活动性强的结论。
①要比较产生气体的快慢,可以测量相同时间内产生气体的体积,也可以测量 ▲ 。通过有关实验数据,乙得出了锌比铁的活动性强的结论。
②实验测得锌片产生的气体的速率(v)与时间(t)的关系如图2所示,则t1-t2时间内反应速率逐渐加快的主要原因是 ▲ 。
(3)丙两位同学认为上述实验方案不足以得出4种金属的活动性顺序,并在上述实验的基础上,补充了一个实验(如右图所示),得到了探究结论。则丙同学的实验中:X是金属 ▲ ,Y是 ▲ 溶液。
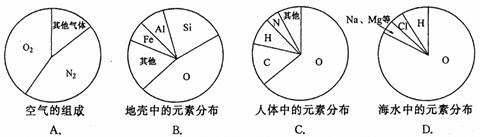
 A.碘元素属于金属元素
A.碘元素属于金属元素
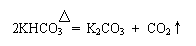 (1)目前有以超临界(一种介于气态和液态之间的状态)CO2来代替以前的氟利昂作致冷剂,这种做法对环境的积极意义在于
▲ 。
(1)目前有以超临界(一种介于气态和液态之间的状态)CO2来代替以前的氟利昂作致冷剂,这种做法对环境的积极意义在于
▲ 。
 (4分)下图是初中化学中常见物质间的转化关系,其中只有甲为单质,其他都是化合物; A是植物进行光合作用的一种重要原料,B的相对分子质量小于20,C可用于中和酸性土壤。反应②属于中和反应,图中“-”表示两端的物质能发生化学反应;“ ”表示物质间存在转化关系,其余反应条件、部分反应物和生成物均已略去。
(4分)下图是初中化学中常见物质间的转化关系,其中只有甲为单质,其他都是化合物; A是植物进行光合作用的一种重要原料,B的相对分子质量小于20,C可用于中和酸性土壤。反应②属于中和反应,图中“-”表示两端的物质能发生化学反应;“ ”表示物质间存在转化关系,其余反应条件、部分反应物和生成物均已略去。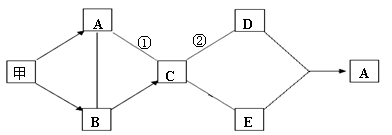
 甲 B: ▲ ;反应①: ▲ ;
甲 B: ▲ ;反应①: ▲ ;