28.(10分)某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
[查阅资料]
<资料1> 该厂采用“侯氏制碱法”生产的化工产品为纯碱和氯化铵。(“侯氏制碱法”
是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺。)
<资料2> 生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质。
<资料3> 部分生产流程如下图所示。
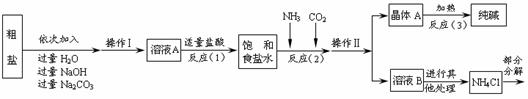
上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH= ▲ ↓+2NaCl;
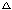 Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl;NH4Cl== NH3↑+HCl↑
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl;NH4Cl== NH3↑+HCl↑
<资料4>生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵
的混合物,其反应的化学方程式为:NaCl+ NH3 + CO2 + H2O= NaHCO3↓+ NH4Cl;分
离出固体产物,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方
程式为 ▲ 。
[问题讨论]
(1)溶液A中的溶质为 ▲ ,操作Ⅱ的名称为 ▲ 。
(2)上述生产流程中可循环使用的是 ▲ (填序号)。
A. CO2 B. NH3 C. HCl D.NaOH E. Na2CO3
(3)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠。
|
实验步骤 |
实验现象 |
实验结论 |
|
▲ |
▲ |
▲ |
[含量测定]
研究小组的同学们为了测定该纯碱样品的纯度,设计了如下实验。
甲组:
取10.0 g纯碱样品(假定杂质在整个实验过程中不发生变化),向其中加入过量的盐酸,
 直至样品中无气泡冒出。充分加热蒸发所得物质并
直至样品中无气泡冒出。充分加热蒸发所得物质并
干燥、冷却至室温后称量,所得固体质量为10.9 g。
样品中碳酸钠的质量分数为 ▲ (结果保留一
位小数)。
乙组:
取10.0 g纯碱样品,利用右图所示装置,测出反应
后装置C增重了3.5 g(所加试剂均足量)。实验结束后,发现乙组测定的质量分数偏小,
其原因是 ▲ 。
2011届中考复习调研性检测试卷(一)
26.(6分)科学探测发现月球贮存有一定数量的冰尘混合物、甲烷和钛铁矿(主要成分
FeTiO3)资源。人类有望利用月球上的水资源,并通过电解获取氢气为火箭提供燃料,
获取的氧气可逐渐形成或供呼吸的大气层,用来满足植物和人类所需。下图是根据科学
家设想的有关人类利用月球资源的流程图。
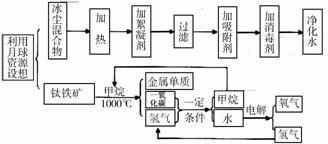
(1)得到净化水的过程中,可做吸附剂的物质有 ▲ (填一种物质名称)
(2)该流程图中可循环利用的物质是 ▲ 和 ▲
(3)推测流程图中的“金属单质”是 ▲
(4)根据流程图的信息,写出CO和H2反应的化学方程式 ▲ 。
(5)纯水的导电能力极弱。电解水时可加入硫酸、氢氧化钠等物质增加导电性。给10%
的硫酸溶液通电(实质为电解水,硫酸不发生化学变化)时,获得下列四组实验数
据,你认为其中最接近理论值的一组是 ▲ (填字母序号)
|
|
氧气质量/g |
氢气质量/g |
硫酸的质量分数 |
|
A |
64 |
8 |
10% |
|
B |
10 |
2 |
10% |
|
C |
16 |
2 |
11% |
|
D |
16 |
32 |
11% |
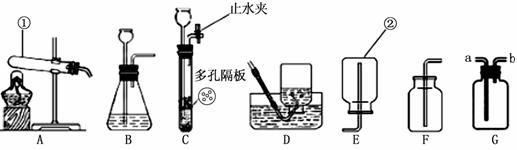
24.(8分)某化学兴趣小组利用“稀盐酸、硫酸铜、氢氧化钠、氯化钡”几种物质对复分
解反应进行再探究。
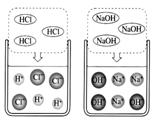 [查阅资料]大多数强酸、强碱和盐类物质溶解于水时,在水
[查阅资料]大多数强酸、强碱和盐类物质溶解于水时,在水
分子的作用下发生了电离,产生了能够自由移动的阴、
阳离子。如图是HCl和NaOH在水中解离出离子的示意
图,HCl在水中会解离出H+和Cl-,NaOH在水中会解离
出Na+和OH-。以此类推,AgNO3在水中会解离出的离
子是 ▲ 和 ▲ (填离子符号)。
[提出问题]如何证明稀盐酸和氢氧化钠溶液发生反应了呢?
[实验设计]
|
实验步骤 |
实验现象 |
实验结论 |
|
▲ |
▲ |
▲ |
[反思质疑1]溶液中的离子都参加反应了吗?
[实验设计]
|
编号 |
实验 |
现象 |
|
1 |
向盛有CuSO4溶液的试管里加入适量的 NaCl溶液。 |
没有明显变化,溶液仍为蓝色 |
|
2 |
向盛有CuSO4溶液的试管里加入适量的 BaCl2溶液。 |
有 ▲ 生成,滤液为蓝色 |
[得出结论]通过对上述实验现象的分析,我们可以得出这样的结论:CuSO4溶液和
BaCl2溶液反应,实质参加反应的是Ba2+和SO42-,它们结合生成BaSO4沉淀,而
Cl-和Na+则是旁观者,并没有参加反应。
[反思质疑2]反应前后单位体积的溶液中能够自由移动的离子的数目有无改变?
 [研究讨论]稀盐酸与氢氧化钠溶液的反应我们可以用下图表示:
[研究讨论]稀盐酸与氢氧化钠溶液的反应我们可以用下图表示:

 请你在下图圆圈中▲处将BaCl2溶液和CuSO4溶液反应的产物补充完整:
请你在下图圆圈中▲处将BaCl2溶液和CuSO4溶液反应的产物补充完整:

[表达交流]通过上述探究我们可以得出酸碱盐在溶液中发生复分解反应的实质是:
▲
19.下表列出了除去物质中所含少量杂质的方法,其中正确的是
|
|
物质 |
所含杂质 |
除去杂质的方法 |
|
A |
CO2气体 |
CO |
通入氧气后点燃 |
|
B |
NaOH溶液 |
Na2CO3 |
加入足量稀盐酸至不再产生气泡 |
|
C |
炭粉 |
CuO粉末 |
加入过量稀硫酸,过滤 |
|
D |
FeSO4溶液 |
CuSO4 |
加入足量锌粒,充分反应,过滤 |
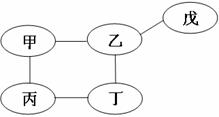
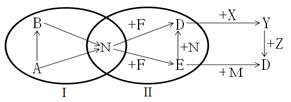 (4分)下列图示中A、B、D、E、F、M、N、X、Y、Z都是初中化学常见的物质。“→”
(4分)下列图示中A、B、D、E、F、M、N、X、Y、Z都是初中化学常见的物质。“→”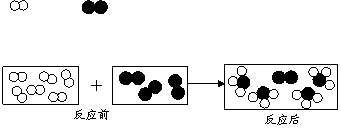 (3分) 用“ ”和“ ”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下:
(3分) 用“ ”和“ ”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下: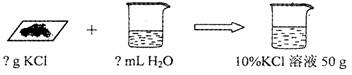
 ②称量:用托盘天平称取所需固体,再用 ▲ mL的量筒量取所需的水;
②称量:用托盘天平称取所需固体,再用 ▲ mL的量筒量取所需的水;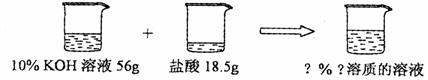
 种物质能在一定条件下发生反应)。下列有关说
种物质能在一定条件下发生反应)。下列有关说