27.(18分)根据下列表格,回答有关问题。
|
族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
二 |
|
|
|
① |
② |
③ |
④ |
|
|
三 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
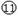 |
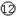 |
(1)在上表①-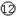 所给元素中,第一电离能最小的是
,最大的是 ,电负性最大的是 (填元素名称)。
所给元素中,第一电离能最小的是
,最大的是 ,电负性最大的是 (填元素名称)。
(2)这些元素最高价氧化物对应水化物中, 酸性最强, 碱性最强,呈两性的是 (填化学式)
(3)在⑤-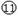 元素的原子中, 原子半径最大,未成对电子数最多的是 ,有两个未成对电子的元素是
(填元素名称)。
元素的原子中, 原子半径最大,未成对电子数最多的是 ,有两个未成对电子的元素是
(填元素名称)。
28(10分).W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第_________周期第_________族。W的气态氢化物稳定性比H2O(g) __________(填“强”或“弱”)。
(2)Y的基态原子核外电子排布式是 ,Y的第一电离能比X的__________(填“大”或“小”)。
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
________________________________________________________________。
Ⅱ卷 共50分
26.(9分)下表列出了钠的卤化物的熔点:
|
NaX |
NaF |
NaCl |
NaBr |
NaI |
|
熔点 |
995 |
801 |
775 |
651 |
回答下列问题:
(1)NaF 的熔点比NaBr的熔点高的原因是 。
(2)卤化钠的晶格能由高到低的顺序为 ,硬度由大到小的顺序为 。