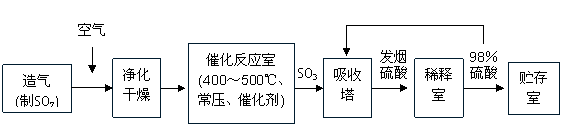
23.(17分)工业制硫酸生产流程如下图:
|

(1)已知2SO2(g)+O2(g) 2SO3(g),ΔH=-196
kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2mol SO2和1mol O2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是____________________________。 下列描述中能说明上述反应已达平衡的是___________
A.v(O2)正=2v(SO3)逆 B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化 D.容器中气体的分子总数不随时间而变化
2SO3(g),ΔH=-196
kJ·mol-1。在450℃、常压和钒催化条件下向一密闭容器中充入2mol SO2和1mol O2,充分反应后,放出的热量______(填“<”“>”“=”)196kJ,理由是____________________________。 下列描述中能说明上述反应已达平衡的是___________
A.v(O2)正=2v(SO3)逆 B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化 D.容器中气体的分子总数不随时间而变化
(2)在450℃、常压和钒催化条件下,在容积为5 L的容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO3 0.18mol。
①求该温度下反应2SO2(g)+O2(g) 2SO3(g)的平衡常数K =__________,O2的平均消耗速率v(O2)=__________,和SO2的平衡转化率a(SO2)=___________。
2SO3(g)的平衡常数K =__________,O2的平均消耗速率v(O2)=__________,和SO2的平衡转化率a(SO2)=___________。
②若继续通入0.20molSO2和0.10molO2,则平衡______移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后,______ mol<n(SO3)<______mol。
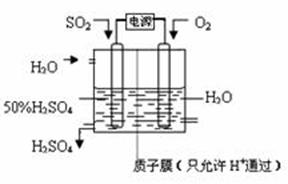 (3)科学家研究出以下图所示装置用电化学原理生产硫酸的新工艺,其阳极的电极反应式为
,总反应的化学方程式为
。
(3)科学家研究出以下图所示装置用电化学原理生产硫酸的新工艺,其阳极的电极反应式为
,总反应的化学方程式为
。
22.(8分)在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应。这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气“的说法不一致。为排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象。
实验用品:仪器(略,凡是实验需要的都有)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三根相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况。结果如下:
|
反应进程(分钟) |
1 |
2 |
5 |
15 |
20 |
|
3.0mol/L盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
|
1.5mol/L硫酸 |
均无明显现象(无气泡产生) |
||||
|
3.0mol/L硫酸 |
均无明显现象(无气泡产生) |
通过上述实验可知,无论是用1.5mol/L硫酸还是3.0mol/L硫酸,均无明显的现象,而3.0mol/L盐酸与铝片反应的现象却十分明显。
(1)写出铝与酸反应的离子方程式__________________________________________
(2)反应1-15min内,铝与盐酸的反应速率逐渐加快,其原因是___________________。
(3)根据以上探究“铝与稀盐酸和稀硫酸反应差异的原因”,你能对问题原因作出哪些假设或猜想(列出两种即可)
假设一:______________________________________________________
假设二:________________________________________________________
 A.危险垃圾 B.可回收物
A.危险垃圾 B.可回收物 Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
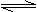
 Cr2O72-(橙红色)+H2O
Cr2O72-(橙红色)+H2O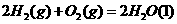

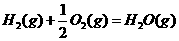
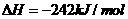
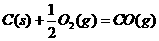
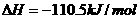
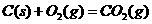
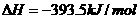
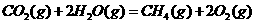

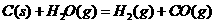 的
的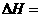 ;
;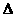 S
0(选填“>”、“=”、“<”);
S
0(选填“>”、“=”、“<”);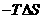 (T指温度),当
(T指温度),当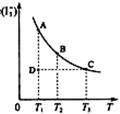 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq) ,某 I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是:( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq) ,某 I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是:( )