20.(10分)在一次学生实验中,学生用铝片分别和稀盐酸、稀硫酸反应,发现:铝片与稀盐酸反应现象非常明显,而和稀硫酸几乎不反应。这和教材中“铝能跟稀盐酸或稀硫酸反应生成氢气“的说法不一致。已排除因试剂变质等因素造成的影响,该学生在教师的指导下重新进行下列实验,验证是否存在上述现象。
实验用品:仪器(略,凡是实验需要的都有)
药品:3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,相同大小的铝片(纯度>99.5%)
实验过程:往三支相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol/L盐酸、1.5mol/L硫酸、3.0mol/L硫酸,观察反应进行到1、2、5、15、20分钟时的铝与酸反应的情况。结果如下:
|
反应进程(分钟) |
1 |
2 |
5 |
15 |
20 |
|
3.0mol/L盐酸 |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
|
1.5mol/L硫酸 |
均无明显现象(无气泡产生) |
||||
|
3.0mol/L硫酸 |
均无明显现象(无气泡产生) |
通过上述实验可知,无论是用1.5mol/L硫酸还是3.0mol/L硫酸,均无明显的现象,而3.0mol/L盐酸与铝片反应的现象却十分明显。
(1)写出铝与酸反应的离子方程式______________________________________________
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,其原因是_______________________
________________________________________________________________________________。
(3)同学们在探究0.01mol/L KMnO4溶液与0.2mol/L H2C2O4溶液发生反应2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O时发现,反应前阶段KMnO4溶液褪色速率非常缓慢,但后阶段的褪色速率却非常快,同学们分析后阶段褪色速率却非常快是因为某物质对上述反应起了______作用,该物质可能是_________。
(4)受上述探究实验的启发,同学们顺利提出了“铝与稀盐酸和稀硫酸反应差异的原因”。你能对该问题原因做出某些假设或猜想吗?(列出两种即可,Al3+的影响已经排除)
假设一:________________________________________________________________________;
假设二:________________________________________________________________________;
如何设计实验验证你的假设,请简述你设计的实验的要点:
_______________________________________________________________________________。
17.(12分)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
请回答下列问题:
(1)煤的气化的主要化学反应方程式为:_____________________________________。
(2)利用水煤气合成二甲醚的三步反应如下:
① 2H2(g)
+ CO(g) CH3OH(g);ΔH=-90.8 kJ·mol-1
CH3OH(g);ΔH=-90.8 kJ·mol-1
② 2CH3OH(g) CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g) CO2(g) +
H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) +
H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g)
+ 3CO(g) CH3OCH3(g) + CO2 (g)的ΔH= ___________;
CH3OCH3(g) + CO2 (g)的ΔH= ___________;
一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是__________(填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(3)已知反应②2CH3OH(g) CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下:
|
物质 |
CH3OH |
CH3OCH3 |
H2O |
|
浓度/(mol·L-1) |
0.44 |
0.6 |
0.6 |
① 比较此时正、逆反应速率的大小:v正 ______ v逆 (填“>”、“<”或“=”)。
② 若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH) = _________;该时间内反应速率v(CH3OH) = __________。
 C在温度T1下进行,反应D+E
C在温度T1下进行,反应D+E Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时V(B)=0.9a升,试回答:
Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时V(B)=0.9a升,试回答: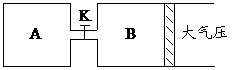 (1)B中X 的转化率α(X)B为__________。
(1)B中X 的转化率α(X)B为__________。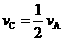 ;反应2min 时,A的浓度减少了
;反应2min 时,A的浓度减少了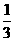 ,B的物质的量减少了
,B的物质的量减少了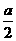 mol,有a mol D生成。
mol,有a mol D生成。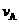 =
,
=
,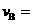 ;
;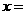 、
、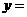 、
、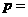 、
、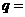 ;
;
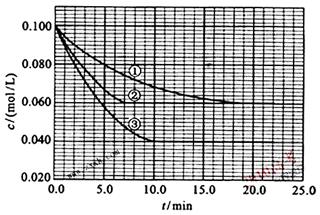
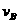 =_____________________________________________________________
=_____________________________________________________________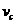 =______________________________________________________________
=______________________________________________________________