0 28903 28911 28917 28921 28927 28929 28933 28939 28941 28947 28953 28957 28959 28963 28969 28971 28977 28981 28983 28987 28989 28993 28995 28997 28998 28999 29001 29002 29003 29005 29007 29011 29013 29017 29019 29023 29029 29031 29037 29041 29043 29047 29053 29059 29061 29067 29071 29073 29079 29083 29089 29097 447348
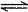 H++OH-、_________________________和__________________________(用离子方程式表示)。
H++OH-、_________________________和__________________________(用离子方程式表示)。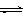 H+ +
In-(aq)
H+ +
In-(aq)