27.(16分)现有部分短周期元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
M层上有2对成对电子 |
|
X |
最外层电子数是次外层电子数的2倍 |
|
Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
|
Z |
元素最高正价是+7价 |
(1)元素T的原子最外层共有 种不同运动状态的电子。元素X的一种同位素可测定文物年代,这种同位素的符号是 。
(2)元素Y与氢元素形成一种离子YH4+ ,写出该微粒的电子式 (用元素符号表示)
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是_____。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
非金属性强弱的判断方法有很多种,请写出另一种判断方法(用化学方程式表示):
_____________________________________________________________
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 ,理由是_______________ _____ ___ 。
26.(18分)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
|
b |
|
|
|||||||||||||||
|
|
|
|
|
h |
|
j |
|
|
|||||||||
|
a |
c |
f |
|
i |
|
l |
m |
||||||||||
|
|
|
|
e |
|
|
|
|
|
|
|
|
|
g |
|
|
|
|
|
|
d |
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
(1)上述元素的单质可能是电的良导体的是______(填字母代号)。
(2)下表是一些气态基态原子的第一、二、三、四级电离能(kJ·mol-1):
|
|
锂 |
X |
Y |
|
第一电离能 |
519 |
502 |
580 |
|
第二电离能 |
7296 |
4570 |
1820 |
|
第三电离能 |
11799 |
6920 |
2750 |
|
第四电离能 |
|
9550 |
11600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量_______________________________。
②表中Y可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j形成化合物的电子式是 ________和_________ 。
(3)写出元素e的电子排布式____________________。
(4)以上13种元素中, (填写字母)元素原子失去核外第一个电子需要的能量最多。
(5)根据元素原子的外围电子排布的特征,可将元素周期表分成几个区域,其中,元素c、m分别位于________区、__________区
 则下列化合物中能发生
则下列化合物中能发生 B.
B.
 D.
D.
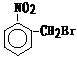
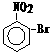
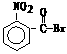
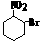
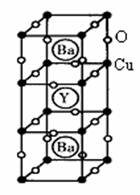
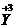 ,
,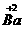 ,
,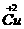 和
和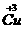 )试计算化合物中这两种价态Cu原子个数比
)试计算化合物中这两种价态Cu原子个数比