17.(14分)
(1)下表是一些共价键的键能
|
共价键 |
Cl-Cl |
N≡N |
H-H |
H-Cl |
H-N |
|
键能(KJ/mol) |
243 |
946 |
436 |
432 |
X |
①下列物质本身具有的能量最低的是 ( )
A.Cl2 B.N2 C.H2 D.NH3
② 已知:N2(g)+3H2(g) 2NH3
△H=-92.4KJ·mol-1,则X为 。
2NH3
△H=-92.4KJ·mol-1,则X为 。
(2)由氢气和氧气反应生成1mol水蒸气,放热241.8KJ。写出该反应的热化学方程式: 。若1g水蒸气转化为液态水放热2.44KJ,则反应H2(g)+1/2O2(g)=H2O(l) △H= KJ·mol-1,氢气的燃烧热为 。
(3)已知下列热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H1=-25KJ/mol;3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) △H2=-47KJ/mol;
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H3=+19KJ/mol;计算
FeO(s)+CO(g)=Fe(s)+CO2(g) 反应的反应热△H= 。
(4)已知常温下NO与O2反应生成1molNO2的焓变为-57.07KJ,1molNO2与H2O反应生成HNO3溶液和NO的焓变为-46KJ,写出NO与O2及水生成HNO3溶液的热化学方程式 。
15.在相同温度和压强下,对反应CO2(g)+H2(g)=CO(g)+H2O (g)进行甲、乙、丙、丁四组实验,,实验起始时放入容器内各组分的物质的量见下表
|
物质的量 |
CO2 |
H2 |
CO |
H2O |
|
甲 |
a mol |
a mol |
0 mol |
0 mol |
|
乙 |
2a mol |
a mol |
0 mol |
0 mol |
|
丙 |
0 mol |
0 mol |
a mol |
a mol |
|
丁 |
a mol |
0 mol |
a mol |
a mol |
上述四种情况达到平衡后,n(CO)的大小顺序是 ( )
A.乙=丁>丙=甲 B乙>丁>甲>丙 C.丁>乙>丙=甲 D.丁>丙>乙>甲
|
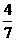 。计算
。计算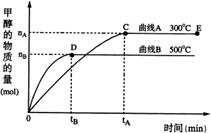 CO(g)+2H2(g)
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)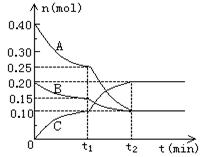 (6分)现将0.4molA气体和0.2molB气体充入10L
(6分)现将0.4molA气体和0.2molB气体充入10L 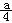 ml,则a与b关系的数学表示式是 。
ml,则a与b关系的数学表示式是 。