20、(12分)化学键的键能是指气态原子间形成1mol化学键时释放的能量。
如H(g)+I(g)→H-I(g),△H=-297KJ/mol即H-I键的键能为297KJ·mol-1,也可以理解为破坏1mol H-I键需要吸收297KJ的热量。下表是一些键能数据(KJ·mol-1):
|
|
键能 |
|
键能 |
|
键能 |
|
键能 |
|
H-H |
436 |
Cl-Cl |
243 |
H-Cl |
432 |
H-O |
464 |
|
S=S |
255 |
H-S |
339 |
C-F |
427 |
C-O |
347 |
|
C-Cl |
330 |
C-I |
218 |
H-F |
565 |
|
|
回答下列问题:
⑴由表中数据能否得出这样的结论:①半径越小的原子形成的共价键越牢固(即键能越大)_______(填“能”或“不能”)②非金属性越强的原子形成的共价键越牢固________(填“能”或“不能”)。试预测C-Br键的键能范围 。
⑵①由热化学方程式H2(g)+Cl2(g)→2HCl(g);△H=-185KJ·mol-1并结合表上数据可推知一个化学反应的反应热(设反应物生成物均为气态)与反应物和生成物的键能之间的关系是 ;
②由热化学方程式2H2(g)+S2(s) →2H2S(g);△H=-224.5KJ·mol-1以及表中数值可计算出1mol S2(s)气化时将________(填“吸收”或“放出”)_______KJ的热量。
⑶瑞士化学家盖斯(Hess G.H)在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的ΔH便是定值,与反应的途径无关。这就是有名的“Hess定律”。
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);ΔH=-25kJ·mol-1
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);ΔH=-47kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);ΔH=+19kJ·mol-1
①请写出CO还原FeO的热化学方程式:
;
②根据以上信息,你认为“Hess定律”在我们确定一些化学反应的反应热时有何重要意义 。
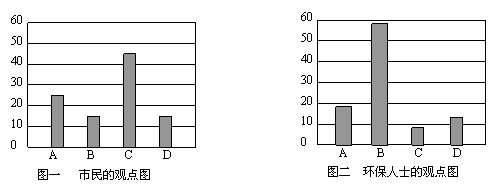 空气污染原因调查人数分布图
空气污染原因调查人数分布图
 PCl3(气)+Cl2(气); △H>0 K=1
①
PCl3(气)+Cl2(气); △H>0 K=1
①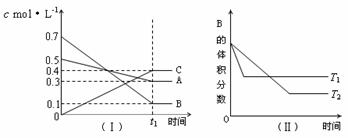
 第Ⅱ卷(非选择题,共78分)
第Ⅱ卷(非选择题,共78分) 2HI(g)的K=50,由此推测在450℃时,反应
2HI(g)的K=50,由此推测在450℃时,反应