34.(20分)某化学反应2A  B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0。反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
|
实验序号 |
浓度(mol/L) |
时间(min) |
|||||||
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|||
|
1 |
温 度 |
8000C |
1.0 |
0.80 |
O.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
8000C |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
|
3 |
8000C |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
|
4 |
8200C |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在0至20分钟时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度c2= mol/L,反应zai 20分钟nei就达到平衡,
可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为v3,实验1的反应速率为v1,则达到平衡时
v3 v1(填>、=、<=)且c3 = mol/L。
(4)比较实验4和实验1,可推测该反应是 反应(选填吸热、放热)。
理由是 。
(5) 800℃时,反应2A  B+D的平衡常数=
, 其他条件不变, 达到平衡时
B+D的平衡常数=
, 其他条件不变, 达到平衡时
|
32.(12分)(1)该学生用标准0.14 mol/L NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。 C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。 F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰
好合适”) ,原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果精确到小数点后二位)
mol/L
|
3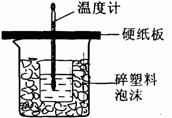 3.(8分)
(1)从实验装置上看,图中尚缺少的一种玻璃用品是
;
3.(8分)
(1)从实验装置上看,图中尚缺少的一种玻璃用品是
;
(2)由图可知该装置有不妥之处,应如何改正?
。
(3)烧杯间填满碎塑料泡沫的作用是 。
(4)大烧杯上如不盖硬纸板,则求得的中和热数值 (填“偏大”、“偏小’、“无影响”)。
(5)实验中改用60 mL 0.50 mol/L的盐酸跟50mL 0.55 mol/L的NaOH溶液进行反应,与
上述实验相比,所放出的热量 (填“相等”或“不相等”),理由
是 ;
若实验操作均正确,所求中和热的数值会 (填“相等”或“不相等”)。