20.把15g大理石高温加热直至没有气体放出,并依次如表5-3实验,称其剩余固体的质量(杂
质不反应不挥发),有关结果记录如表5-3.
表5-3
|
通入紫色石蕊试液 |
通入澄清石灰水 |
称量剩余物 |
|
溶液变为红色 |
石灰水变浑浊,物质总质量增加4.4g |
剩余固体重9.06g |
(1)什么物质使紫色石蕊变红?写出有关化学方程式.___________________________________
(2)求大理石中碳酸钙的质量分数.
答案:(1)碳酸使之变红 CO2+ H2O= H2CO3
(2)设大理石中碳酸钙的质量分数为x
mCO2=15 g-9.06 g=5.94 g
CaCO3 CaO+CO2↑
CaO+CO2↑
100 44
15 g·x 5.94 g
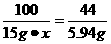
x=90%
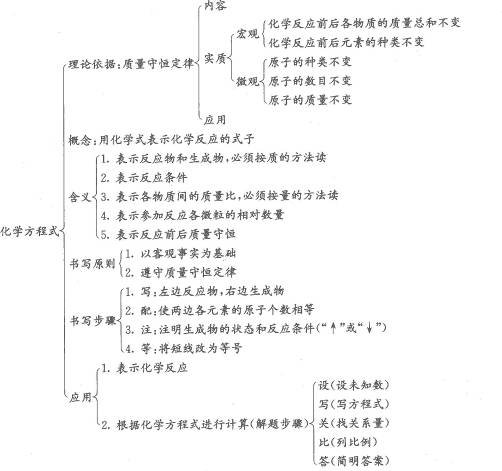
第5单元知识网络
19.为了测定炭粉与氧化铜的混合物中氧化铜的含量,甲、乙、丙、丁四位同学用该样品进行实验,测得的实验数据如表5-2.
(1)混合物中氧化铜的质量分数是________________________.
(2)四位同学中所取稀硫酸不足的是________________________.
(3)求硫酸溶液中的溶质的质量分数________________________.
表5-2
|
物质质量 |
甲 |
乙 |
丙 |
丁 |
|
所取混合样品/g |
25 |
25 |
20 |
20 |
|
加入稀硫酸/g |
50 |
100 |
100 |
120 |
|
反应后剩余固体/g |
21 |
17 |
12 |
12 |
答案:(1)40% 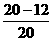 ×100%=40%.
×100%=40%.
(2)甲、乙
(3)9.8%
设硫酸溶液中溶质的质量分数为x
CuO+ H2SO4====CuSO4+ H2O
80 98
8 g 100 g·x
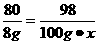
x=9.8%
知识积累
17.将6g镁分别与不同质量的氧气反应.试将表5-1中生成氧化镁的质量填入表5-1并回答:
表5-1
|
氧气的质量/g |
生成氧化镁的质量/g |
|
2 |
|
|
4 |
|
|
8 |
|
|
12 |
|
(1)当第一次与2g氧气反应时,为什么不能生成8gMgO?
(2)从第二次以后,为什么不断增加氧气的质量,生成氧化镁的质量却不增加?
答案:当两种物质发生化学反应时,是按一定质量比进行的,所以在进行化学计算时一定要注意所给的物质是否参加了化学反应,有多少反应了.
(1)因为这时有3g镁剩余未参加反应.
(2)因为从第2次起实际参加反应的氧气只有4g,所以氧气有剩余.
表D5-1
|
氧气的质量/g |
生成氧化镁的质量/g |
|
2 |
5 |
|
4 |
10 |
|
8 |
10 |
|
12 |
12 |
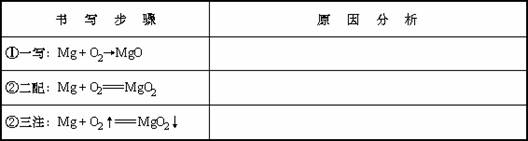
 K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑ MnO2和MnO2.两者质量之比为一定值.
MnO2和MnO2.两者质量之比为一定值.