2、 工业上用电解氧化铝的方法制取单质铝的化学方程式为:
工业上用电解氧化铝的方法制取单质铝的化学方程式为:
2Al2O3===4Al+3O2↑。对“电解10 t氧化铝最多可生产多少吨铝?”一题,小丽和小明两位同学分别采用了两种不同的计算方法。
|
小丽同学的解法 |
小明同学的解法 |
|
解:设铝的质量为x 2Al2O3===4Al+3O2↑ 204 108 10t  x x204/108=10t/x x=108×10 t/204=5.3 t 答:最多可生成  5.3
t铝 5.3
t铝 |
解:氧化铝中铝元素的质量分数: Al的相对原子质量×2/ Al2O3的相对分子质量×100% =27×2/27×2+16×3×100%=53% 铝的质量为:10 t×53%=5.3  t
t答:最多可生成5.3 t铝 |
(二)
1.消毒酒精中酒精的体积分数为70%-75%,则消毒酒精中的溶剂是( )
A.水 B.酒精 C.酒 D.说不定
2.一杯20℃的KNO3饱和溶液,下列方法能改变其溶质质量分数的方法是( )
A.恒温蒸发掉10g水,有晶体析出 B.在该温度下,加入少许KNO3晶体
C. 升温 D. 温度降到10℃,有KNO3,晶体析出
3.对10%的食盐溶液含义的解释错误的是( )
A. 100克水中溶解了10克食盐 B. 100克食盐溶液中含有10克食盐
C. 将10克食盐溶于90克水中所得溶液 D. 食盐与溶液的质量比是1:10
4.常用抗生素“先锋Ⅵ”为粉末状固体,每瓶含“先锋Ⅵ”0.5g,注射时应配成质量分数不高于20%的溶液,则使用时每瓶至少需加入蒸馏水( )
A.1mL B. 2 mL C. 3mL D. 4 mL
5.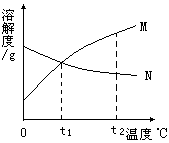 右图是M、N两种物质的溶解度曲, 由溶解度曲线得出以下几条信息,你认为正确的是( )
右图是M、N两种物质的溶解度曲, 由溶解度曲线得出以下几条信息,你认为正确的是( )
A.t1℃时,M、N两物质溶液溶质质量分数相等
B.由t1℃升温到t2℃时,N物质溶液溶质质量分数不变
C.M物质的溶解度大于N物质的溶解度
D.N物质的溶解度随温度的升高而降低
6.已知食盐和纯碱晶体的溶解度如下表所示
|
|
0℃ |
10℃ |
20℃ |
30℃ |
|
NaCl/g |
35.7 |
35.8 |
36.0 |
36.3 |
|
Na2CO3·10H2O/g |
7 |
12.5 |
21.5 |
38.8 |
从表中数据分析:分离氯化钠和纯碱晶体混合物的最佳温度是 。
若将含少量氯化钠的纯碱晶体制成高温下的饱和溶液,当调节到最佳分离温度时,结晶出来的晶体主要是 。为了提高晶体的纯度,应将过滤出的晶体用 (填“冷”或“热”)水进一步洗涤干净。
7.现有80 g质量分数为10%的硝酸钠溶液,试回答下列问题:
(1)上述硝酸钠溶液中含溶质的质量为 ,
(2)若向上述溶液中加入20 g水,则所得溶液中溶质的质量分数为 ;
(3) 若使上述溶液溶质质量分数变为20%,则应加入硝酸钠 g;或蒸发水 g;
(4) 若使上述溶液中溶质的质量分数变为5%,则应加水 g
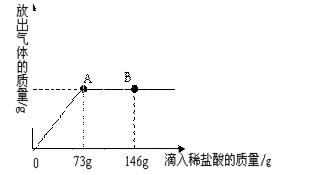 在一烧杯中盛有22.3 g Na2CO3和NaCl组成的固体混合物,加足量水溶解,配成溶液。向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示。请根据题意回答问题:
在一烧杯中盛有22.3 g Na2CO3和NaCl组成的固体混合物,加足量水溶解,配成溶液。向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示。请根据题意回答问题: 过氧化钙(化学式为CaO2)能杀菌消毒,且能与水反应产氧气,其化学方程式为2CaO2+2H2O=2Ca(OH)2+O2↑.某同学把1.8 g不纯的过氧化钙样品(杂质不与水反应)加入到盛有足量水的烧杯中,完全反应后,生成了0.224 L氧气(氧气的密度为1.43 g/L).请计算:
过氧化钙(化学式为CaO2)能杀菌消毒,且能与水反应产氧气,其化学方程式为2CaO2+2H2O=2Ca(OH)2+O2↑.某同学把1.8 g不纯的过氧化钙样品(杂质不与水反应)加入到盛有足量水的烧杯中,完全反应后,生成了0.224 L氧气(氧气的密度为1.43 g/L).请计算: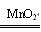 2KCl+3O2↑,将10 g氯酸钾和2 g二氧化锰混合后放入大试管中加热,收集所需氧气后,停止加热让试管冷却,称得试管内剩余固体的质量为7.2 g,求生成氯化钾的质量。
2KCl+3O2↑,将10 g氯酸钾和2 g二氧化锰混合后放入大试管中加热,收集所需氧气后,停止加热让试管冷却,称得试管内剩余固体的质量为7.2 g,求生成氯化钾的质量。 4、某同学把足量的铁粉放入100 g稀硫酸中,并想通过硫酸的多少来计算生成氢气的质量,但发现少一个数据。这个数据是什么?若想通过一定的方法测出生成氢气的质量,请设计一个实验方案(简述实验操作)(友情提示:涉及到的化学方程式为:Fe+H2SO4=FeSO4+H2↑)
4、某同学把足量的铁粉放入100 g稀硫酸中,并想通过硫酸的多少来计算生成氢气的质量,但发现少一个数据。这个数据是什么?若想通过一定的方法测出生成氢气的质量,请设计一个实验方案(简述实验操作)(友情提示:涉及到的化学方程式为:Fe+H2SO4=FeSO4+H2↑)

 (二)酸的化学性质
(二)酸的化学性质