(四)、物质结构 元素周期律
1、构成原子的三种基本微粒是 、 、 。
2、符号 AZXn+中,A表示 ,Z表示 ,n表示 。
3、核素是指
;氢元素的三种核素是 。
4、同位素是指
;下列互为同位素的是 。
A、16O B、O2 C、 O3 D、18O
5、元素周期律是指
。元素周期律的具体体现形式是
。
 6、元素周期表中, 称为周期, 称为族,周期有 个,含元素最多的周期是
,含元素最多的族是 。
6、元素周期表中, 称为周期, 称为族,周期有 个,含元素最多的周期是
,含元素最多的族是 。
7、过渡元素是指 ,过渡元素都是 。
8、碱土金属元素包括 ,其中有国防金属美誉的是 。
9、利用元素周期表寻找新材料,在过渡元素中寻找 ,在 处寻找半导体材料。
10、周期表中,原子半径最小的元素是 ,非金属性最强的
是 ;短周期元素中,金属性最强的是 ,最高价氧化物对应的水化物酸性最强的是 。
11、用化学式填表:
|
项目 |
分子 |
阳离子 |
阴离子 |
|
10电子微粒 |
|
|
|
|
18电子微粒 |
|
|
|
12、填表
|
项目 |
判断金属活动性强弱的依据 |
项目 |
判断非金属活动性强弱的依据 |
|
1 |
|
1 |
|
|
2 |
|
2 |
|
|
3 |
|
3 |
|
|
4 |
|
4 |
|
|
5 |
|
5 |
|
13、下列物质中含有离子键的是 ,含有共价键的是
不含化学键的是 ,既有离子键又有共价键的是
A、He B、CH4 C、CaO D、NH4Cl E、H2SO4 F、MgCl2 G、NaOH H、SO3 I、Na(Al﹙OH﹚4)
14、 下列变化不破坏化学键的是 ,只破坏离子键的是
破坏共价键的是
A、冰融化 B、碘升华 C、NaCl融化 D、NaOH溶于水 E、HCl溶于水 F、蔗糖溶于水 G、NaHCO3受热分解
15、下列物质属于共价化合物的是 ,属于离子化合物的是
A、 C2H4 B、C2H5OH C、HNO3 D、CaCO3 E、H2O2 F、O3 G、NH4NO3
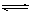 cC + dD 其平衡常数表达式为:
cC + dD 其平衡常数表达式为: