网址:http://m.1010jiajiao.com/timu3_id_198904[举报]
要准确掌握化学用语及常用计量方法。按要求回答下列问题:
(1)NA表示阿伏加德罗常数。28g乙烯和环丁烷(C4H8)的混合气体中含有____NA个碳原子;分子总数为NA个的NO2和CO2混合气体含______ NA个氧原子数;1mol37Cl中,中子数比质子数多_______ NA个;1L 1mol/LFe2(SO4)3溶液中含_____NA个SO42-离子。
(2)图中A、B分别是某微粒的结构示意图,回答下列问题:

①若A表示某元素的原子,则y= 。
②若B表示某稀有气体元素的原子,则该元素的单质的化学式为 ,若B是阴离子的结构示意图,则x的取值范围是________________。
(3)RxO42-中R的化合价为___________(用含x 的式子表示),当0.3 mol RxO42-完全反应,生成RO2时,转移0.6 mol电子,则x=__________。
(4)将7.8 g镁铝合金与100mL 稀硫酸恰好完全反应,将反应后的溶液加热蒸干,得到无水硫酸盐46.2 g,则原硫酸的物质的量浓度为______________。
查看习题详情和答案>>
氯气在科技、生产中应用广泛。
(1)工业上常用熟石灰和氯气反应制取漂白粉,化学方程式是 。
(2)实验室用MnO2与浓盐酸反应制取氯气的原理如下:MnO2
+ 4HCl MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
①若制取11.2 L Cl2(标准状况),则最少应加入MnO2的质量为______g。
②用平衡移动原理解释可用排饱和食盐水法收集氯气的原因 。(结合必要的化学用语及文字回答)
③制备氯气时,可用NaOH溶液吸收尾气,下列试剂也可用于吸收氯气的是____(填字母)。
a. KI溶液 b. FeCl2溶液 c. KCl溶液
写出你选择的吸收试剂与Cl2反应的离子方程式:_______。
④也可用浓氨水吸收氯气,同时生成一种无污染的气体,反应的化学方程式是_______。
查看习题详情和答案>>
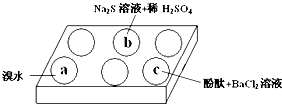 某化学小组进行Na2SO3 的性质实验探究.
某化学小组进行Na2SO3 的性质实验探究.(1)在白色点滴板的a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加如图所示的试剂:
实验现象如下表:
| 编号 | 实验现象 |
| a | 溴水褪色 |
| b | 产生淡黄色沉淀 |
| c | 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去 |
①a中实验现象证明Na2SO3具有
②b中发生反应的离子方程式是
③应用化学平衡原理解释c中现象(用化学用语及简单文字表述)
(2)在用NaOH 溶液吸收SO2 的过程中,往往得到Na2SO3和NaHSO3 的混合溶液,溶液pH 随n(SO32-):n(HSO3-) 变化关系如下表:
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
A.c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(OH-)>c(H+)
C.c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
②若n(SO32-):n(HSO3-)=3:2,则0.8mol NaOH溶液吸收了标准状况下的SO2
(6分)(用化学用语及必要的文字回答)
(1) 配制碳酸钾溶液要加少量的__ ___,原因是____ 。
(2)FeCl3溶液蒸干并灼烧得到的固体是___ __,原因是______ 。
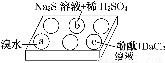
某化学小组进行Na2SO3的性质实验探究。
在白色点滴板的a、b、c三个凹槽中滴有Na2SO3溶液,再分别滴加下图所示的试剂:
实验现象如下表:
编号 | 实验现象 |
a | 溴水褪色 |
b | 产生淡黄色沉淀 |
c | 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去 |
根据实验现象进行分析:
(1)a中实验现象证明Na2SO3具有________性。
(2)b中发生反应的离子方程式是_____________________________________________
(3)应用化学平衡原理解释c中现象(用化学用语及简单文字表述)__________________________________________________________。
查看习题详情和答案>>