[自主研学]:
实验室需要制取一定量的氢气。将0.65g金属锌放入10mL物质的量浓度为2mol/L的盐酸中,它们恰好完全反应,生成的氢气的体积为0.224L(STP)。请分析下面表格:
|
化学反应 |
Zn + 2HCl == ZnCl2 + H2 |
|||||
|
微粒数 |
0.01×NA个 |
0.02×NA个 |
0.01×NA个 |
0.01×NA个 |
||
|
微粒数之比 |
1 : 2 : 1 : 1 |
|||||
|
物质的量 |
0.01mol |
0.02mol |
0.01mol |
0.01mol |
||
|
物质的量之比 |
1 : 2 : 1 : 1 |
|||||
|
质量或气体体积 |
0.65g |
0.73g |
1.36g |
0.02g或0.224L(STP) |
||
由上表可知:化学方程式不仅仅可以表示反应物和生成物各物质间的关系,还可以表示反应物和生成物各物质间分子数之比、质量之比和物质的量之比;如果是气态物质,还可以表示它们彼此之间的体积比;且反应物和生成物各物质间物质的量之比等于化学方程式中各对应物质的化学计量数之比。它们之间的比值在应用时要特别注意:左右单位可不同,但要一一对应;上下单位要一致。即:“左右对应,上下一致”。这样,进行有关化学方程式的计算时,过程简炼,准确率高。如:
2H2 + O2 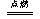 2H2O
2H2O
2mol 22.4L 2×18g
4mol 44.8L 72g
 名师讲题
名师讲题
模块一、物质的量及其单位--摩尔
例1.下列关于物质的量的叙述中,错误的是( )
A.1mol任何物质都含有6.02×1023个分子
B.0.12kg 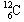 中含有6.02×1023碳原子
中含有6.02×1023碳原子
C.1mol水中含有2mol氢和1mol氧
D.1molNe中含有6.02×1024电子
解析:因为有些物质是由分子构成的(例如水、硫酸等),有些物质是由离子构成的[例如NaCl、Ca 等],还有些物质是由原子直接构成的(例如金刚石等),所以A的叙述是错误的。碳是由原子构成的,根据规定,0.012kg
等],还有些物质是由原子直接构成的(例如金刚石等),所以A的叙述是错误的。碳是由原子构成的,根据规定,0.012kg 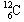 中所含的碳原子数即为阿伏加德罗常数,其近似值为6.02×1023mol-,所以B的叙述是正确的。根据规定,“使用摩尔表示物质的量时,应该用化学式指明粒子的种类,而不使用该粒子的中文名称”,C中表示水的组成时,却用名称表示,所以也是不正确的。氖原子核外有10个电子,则1molNe也应含有10×6.02×1023个电子,所以D的叙述是正确的。
中所含的碳原子数即为阿伏加德罗常数,其近似值为6.02×1023mol-,所以B的叙述是正确的。根据规定,“使用摩尔表示物质的量时,应该用化学式指明粒子的种类,而不使用该粒子的中文名称”,C中表示水的组成时,却用名称表示,所以也是不正确的。氖原子核外有10个电子,则1molNe也应含有10×6.02×1023个电子,所以D的叙述是正确的。
答案:AC
[自主研学]:
1.下列说法正确的是( )
A.摩尔是物理量之一
B.某物质含有6.02×1023个微粒,这一定量的物质就是1mol
C.1mol H
D.0.1mol金属镁变成镁离子时失去的电子数为0.1NA
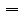
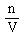
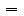
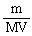 ,由公式可知:实验过程容易在溶质的质量m和溶液的体积V上产生误差,致使物质的量浓度产生了误差。分析可知:
,由公式可知:实验过程容易在溶质的质量m和溶液的体积V上产生误差,致使物质的量浓度产生了误差。分析可知: Ⅳ.未冷却至室温且配制溶液时是放热的过程,使溶液得真实体积V偏小,物质的量浓度C偏高;配制溶解过程是吸热的,未恢复到室温,使溶液的真实体积V偏大,物质的量浓度C偏低。
Ⅳ.未冷却至室温且配制溶液时是放热的过程,使溶液得真实体积V偏小,物质的量浓度C偏高;配制溶解过程是吸热的,未恢复到室温,使溶液的真实体积V偏大,物质的量浓度C偏低。