3.物质的量浓度与质量分数的关系
C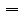
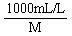 ρω
ρω
其中,C表示溶液的物质的量浓度,单位是mol/L。ρ表示溶液的密度,单位是g/cm3。ω表示溶液的质量分数。M表示溶质的摩尔质量,单位是g/mol。
特别提示:
(1).物质的量浓度和溶液中溶质的质量分数的比较:
|
内容 |
物质的量浓度 |
溶质的质量分数 |
|
定义 |
以单位体积溶液所含溶质的物质的量来表示溶液组成的物理量 |
用溶质的质量与溶液的质量之比表示溶液组成的分数 |
|
溶质的单位 |
mol |
g |
|
溶液的单位 |
L |
g |
|
计算公式 |
物质的量浓度C 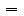 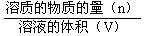 |
溶质的质量分数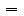  ×100% ×100% |
|
特点 |
①体积相同,物质的量浓度也相同的任何溶液中,所含溶质的物质的量相同,但溶质的质量不一定相同 |
①质量相同,溶质的质量分数也相同任何溶液中,所含溶质的质量相同,但溶质的物质的量不一顶相同 |
|
②将一份溶液分割为若干份,各份体积中所含溶液的溶质的物质的量可能不同,但它们的浓度不变,是相同的。 ③将溶液进行稀释或浓缩后,溶液的体积和浓度变了,但溶质的质量、物质的量不变。 |
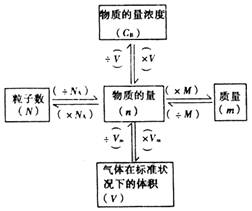
(2).以物质的量为中心的网络关系图:
[质疑激趣]:
一定质量分数的溶液配制是将已称取好的溶质加入到盛有一定质量的水的烧杯中,用玻璃棒搅拌均匀即可。而一定物质的量浓度的溶液是怎样配制的?
2. 摩尔质量
(1).定义: ,
符号: ,单位: ,在数值上等于该物质的
或 。
(2).物质的量(n)、物质的质量(m)和摩尔质量(M)之间的关系:
M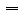
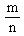
特别提示:
(1).物质的质量、摩尔质量、相对原子(分子)质量的区别与联系
|
物理量 |
物质的质量(m) |
摩尔质量(M) |
相对原子质量(Ar) |
|
概念 |
物体所含物质多少的物理量 |
单位物质的量的物质的质量 |
一种元素的一个原子的质量同一种碳原子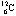 的 的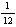 质量的相比所得数值 质量的相比所得数值 |
|
单位 |
g |
g•mol- |
1 |
|
联系 |
①m=nM |
||
|
②摩尔质量在数值上等于该物质的相对原子(分子)质量 |
(2).物质的质量(m)、物质的量(n)、粒子数(N)三者之间的关系:
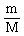
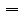 n
n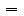

[质疑激趣]:单位物质的量的物质所具有的质量称为该物质的摩尔质量,那么单位物质的量的气体所具有的体积又称为什么?
 (2).溶质是指溶解在溶液中的物质,可以是单质、化合物,也可以是离子。
(2).溶质是指溶解在溶液中的物质,可以是单质、化合物,也可以是离子。 在相同
和
下,相同
的任何气体都含有相同
在相同
和
下,相同
的任何气体都含有相同
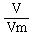
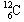 含有6.02×1023个
含有6.02×1023个