(五)、氧化性和还原性及其强弱的判断方法
常见的氧化剂:KMnO4,浓H2SO4,浓、稀HNO3,Cl2
常见的还原剂:H2、CO、C、大多数金属。
1、氧化剂的氧化性>氧化产物的氧化性
还原剂的还原性>还原产物的还原性
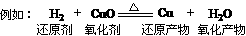
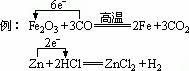
则:还原性:H2>Cu
2、(1)随着金属活动顺序表中金属活动性的减弱,金属的还原性越来越弱,其对应离子的氧化性越来越强.(除Fe3+外)
|
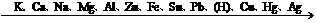
|
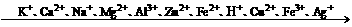
(2)对于非金属单质
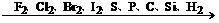 氧化性逐渐减弱
氧化性逐渐减弱
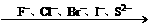 还原性逐渐增强
还原性逐渐增强
3、从反应条件来比较。一般来讲,一组反应中,反应条件越简单,对应反应物的氧化性或还原性越强.
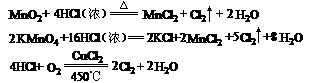
从反应条件可以看出氧化剂的氧化能力:KMnO4>MnO2>O2
4、根据氧化产物的价态高低判断:当变价的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态的高低来判断氧化剂氧化性的强弱。例如:2Fe+3Cl2=2FeCl3 Fe+S=FeS可以判断氧化性Cl2强于S.
[巩固性练习]6、已知 2Fe3+ +2I- =2Fe2+ +I2 ,2Fe2+ +Cl2 =2Fe3+ +2Cl- 则有关离子的还原性强弱顺序为
A.Cl->Fe2+>I- B. Fe2+>I->Cl- C.I->Fe2+>Cl- D.Fe2+>Cl->I-
(二) 、从电子转移的角度认识氧化还原反应
|
反应 |
化合价升降 |
电子转移 |
氧化还原情况 |
|
2Na+Cl2==2NaCl |
钠元素 氯元素 |
钠
氯 |
Na发生 反应,被 Cl2发生 反应,被 |
|
H2+Cl2==2HCl |
氢元素 氯元素 |
氢
氯 |
H2发生 反应,被 Cl2发生 反应,被 |
小结:1、从反应前后电子转移的角度看,氧化还原反应是有 的反应;(氧化还原反应的本质)
2、氧化反应是物质 (填“得到”或“失去”)电子的反应;还原反应是物质 (填“得到”或“失去”)电子的反应。
3、氧化还原反应的本质是
4、在氧化还原反应中,失去电子的物质是 ,得到电子的物质是 。
氧化剂: 电子;化合价 ;发生 反应(具有 性);
还原剂: 电子;化合价 ;发生 反应(具有 性)。
5、氧化反应与还原反应同时发生,既对立又统一,在反应中化合价上升和下降总数相等,得到电子和失去电子总数相等。
6、氧化还原反应与四种基本类型反应的关系为:
置换反应全部属于氧化还原反应,复分解反应全部属于非氧化还原反应,
有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
[巩固性练习]2、对于Cl2+SO2+2H2O==H2SO4+2HCl反应,下列说法正确的是( )
① Cl2是氧化剂②SO2被氧化③Cl2被氧化④Cl2发生还原反应⑤SO2具有还原性⑥Cl2具有氧化性
A .只有①②⑥ B.只有②③④ C.只有②④⑤⑥ D.只有①②④⑤⑥
(一)、从元素化合价升降的角度认识氧化还原反应
|
反应 |
是否氧化 还原反应 |
“得”还是 “失”氧 |
化合价升降 |
氧化还原情况 |
|
C+2CuO==2Cu+CO2 |
|
C 氧, CuO 氧 |
碳元素 铜元素 |
C发生
反应,被 CuO发生 反应,被 |
|
C+H2O==H2+CO |
|
C 氧, H2O 氧 |
碳元素 氢元素 |
C发生
反应,被 H2O发生 反应,被 |
小结:①从反应前后元素化合价是否升降看,氧化还原反应是有 的反应(氧化还原反应的特征);②氧化反应是物质所含元素化合价 (填“升高”或“降低”)的反应;还原反应是物质所含元素化合价 (填“升高”或“降低”)的反应。
[巩固性练习]1、判断下列反应是不是氧化还原反应,若是氧化还原反应,指出什么元素被氧化?什么元素被还原?
a.2CuO+C=2Cu+CO2 b.Cl2+2NaOH=NaCl+NaClO+H2O c.Mg+Cl2=MgCl2 d.KClO3+6HCl=KCl+3Cl2+3H2O
 溶液中不断通入
溶液中不断通入 ,溶液中
,溶液中 、
、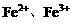 等粒子的物质的量随
等粒子的物质的量随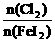 (即
(即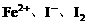 的还原性由弱到强的顺序是_____________;
的还原性由弱到强的顺序是_____________;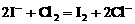 ;
;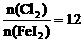 时的反应_____________;
时的反应_____________; (4)当
(4)当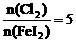 时,溶液中
时,溶液中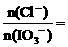 _____________。
_____________。
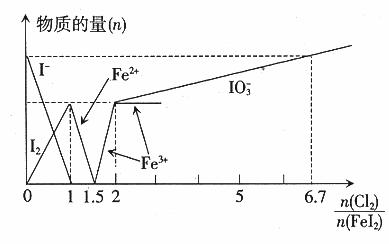
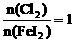 时,
时,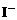 全部氧化为
全部氧化为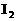 ;
;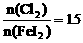 时,
时,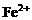 全部氧化为
全部氧化为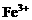 ;
;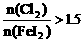 时,I2全部氧化为
时,I2全部氧化为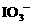 。因此
。因此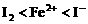 。
。 。
。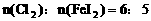 ,此时
,此时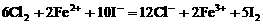 。
。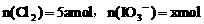 ,则
,则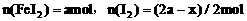
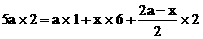
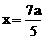


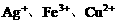 的混合液中加入铁粉,因氧化性
的混合液中加入铁粉,因氧化性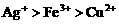 ,
, 先还原
先还原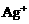 。
。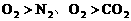 ,Mg先还原O2。
,Mg先还原O2。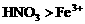 ,若铁粉足量,先发生反应:
,若铁粉足量,先发生反应: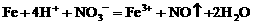 ,后发生的反应:
,后发生的反应: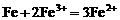 。
。 B.
B.
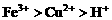 ,可知
,可知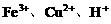 与Fe均反应完,反应后溶液中存在较多的阳离子是
与Fe均反应完,反应后溶液中存在较多的阳离子是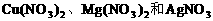 的溶液中加入适量锌粉,首先置换出的是( )
的溶液中加入适量锌粉,首先置换出的是( )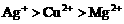 ,Zn先还原
,Zn先还原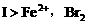 先氧化
先氧化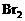 少量,只氧化
少量,只氧化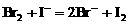 ;若
;若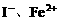 全部被氧化,离子方程式为:
全部被氧化,离子方程式为: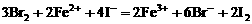 。
。 溶液中同时加入铁粉和铜粉,因还原性
溶液中同时加入铁粉和铜粉,因还原性 先氧化Fe。
先氧化Fe。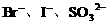 的混合液中通入
的混合液中通入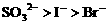 ,
,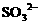 。
。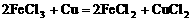 。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )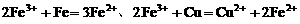 。
。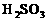 的溶液里通入0.01molCl2,有一半
的溶液里通入0.01molCl2,有一半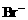 变为
变为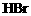 和
和 。
。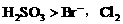 先氧化
先氧化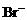 。先后发生反应的离子方程式为:
。先后发生反应的离子方程式为: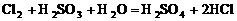 ,
,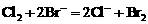 。设原溶液中HBr和
。设原溶液中HBr和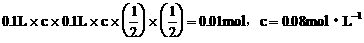 。答案为D项。
。答案为D项。 混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )
混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )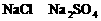
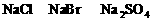
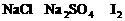
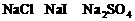
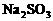 ,若
,若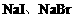 。观察选项可发现
。观察选项可发现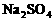 ,只需考虑
,只需考虑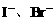 反应情况。由于通入的
反应情况。由于通入的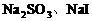 反应生成
反应生成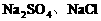 ,剩余物质组成为选项B。不可能出现D选项情况。答案为A、B项。
,剩余物质组成为选项B。不可能出现D选项情况。答案为A、B项。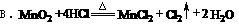
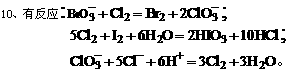
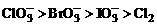 B.
B.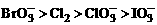
 D.
D.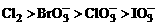
 离子在一定条件下可把Mn2+氧化成
离子在一定条件下可把Mn2+氧化成 ,若反应后
,若反应后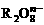 变成
变成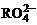 ,又知反应中氧化剂与还原剂的离子个数比为5:2,则
,又知反应中氧化剂与还原剂的离子个数比为5:2,则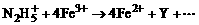 ,作为N2H5+的氧化产物Y可能是(填写化学式)________。
,作为N2H5+的氧化产物Y可能是(填写化学式)________。