2.2AgBr 2Ag+Br2
2Ag+Br2
2Ag+Br2 = 2AgBr
催化作用
[知识验证实验]
某化学课外小组用海带为原料制取了少量碘水.现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液.其实验操作可分为如下几步:
(A)把盛有溶液的分液漏斗放在铁架台的铁圈中;
(B)把50mL碘水和15mLCCl4加入分液漏斗中,并盖好玻璃塞;
(C)检验分液漏斗活塞和上口玻璃塞是否漏液;
(D)倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
(E)旋开活塞,用烧杯接收溶液;
(F)将漏斗上口的玻璃打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
(G)静置,分层.
就此实验,完成下列填空:
(1)正确操作步骤的顺序是:(用上述各操作的编号字母填写)
? ? ?A?________?E?F
(2)上述(E)步骤的操作中应注意 .
(3)能选用CCl4从碘水中萃取碘的原因是______________________________________.
此实践活动要求同学们熟练掌握萃取的原理,掌握萃取和分液的操作方法.
答案:(1)C?B?D?A?G?E?F
(2)使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出;使内外空气相通,以保证进行(E)操作时漏斗里液体能够流出.
(3)CCl4与水不互溶,且碘在CCl4中溶解度比在水中大很多.
[知识探究学习]
试举例说明常见物质的分离规律.
解析 物质的分离是指将混和物里几种物质分开,得出几种比较纯净的物质.
分离方法归纳为下表:
|
混合物类型 |
混合物各组分性质 |
分离方法 |
实例 |
|
固态 |
一种组分可溶,另一种不溶 |
溶解、过滤、蒸发、结晶 |
NaCl与BaSO4分离 |
|
各组分均可溶,但溶解度随温度变化的差异较大 |
溶解、加热、冷却、结晶 |
NaCl与KNO3分离 |
|
|
一组分有易升华的性质 |
加热升华 |
碘与砂子分离 |
|
|
液态 |
各组分互溶,但沸点不同 |
蒸馏(分馏) |
石油分馏 |
|
溶质在两种互不相溶的溶剂中溶解度不同 |
萃取、分液 |
用CCl4提取碘水中的碘 |
|
|
气态 |
各气体与吸收剂作用不同 |
洗气 |
CO与CO2分离 |
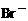 、I-失电子能力递增
、I-失电子能力递增