7.元素金属性和非金属性强弱的判断方法
|
金 属 性 比 较 |
本质 |
原子越易失电子,金属性越强。 |
|
判 断 依 据 |
1.在金属活动顺序表中越靠前,金属性越强。 |
|
|
2.单质与水或非氧化性酸反应越剧烈,金属性越强。 |
||
|
3.单质还原性越强或离子氧化性越弱,金属性越强。 |
||
|
4.最高价氧化物对应水化物的碱性越强,金属性越强。 |
||
5.若xn++y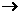 x+ym+ 则y比x金属性强。 x+ym+ 则y比x金属性强。 |
||
|
非 金 属 性 比 较 |
本质 |
原子越易得电子,非金属性越强。 |
|
判 断 方 法 |
1.与H2化合越易,气态氢化物越稳定,非金属性越强。 |
|
|
2.单质氧化性越强,阴离子还原性越弱,非金属性越强。 |
||
|
3.最高价氧化物的水化物酸性越强,非金属性越强。 |
||
4.An-+B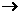 Bm-+A 则B比A非金属性强。 Bm-+A 则B比A非金属性强。 |
5.元素周期律
|
涵 义 |
元素性质随着元素原子序数的递增而呈周期性变化。 |
|
实 质 |
元素性质的周期性递变是核外电子排布周期性变化的必然结果。 |
3.元素周期表的结构
 3个短周期(1、2、3周期)
3个短周期(1、2、3周期)
周期(7个) 3个长周期(4、5、6周期)
1个不完全周期(7周期)
同周期元素性质递变规律:从左到右(稀有气体除外),元素的金属性逐渐减弱,非金属性逐渐增强。
 主族(7个)IA-VIIA
主族(7个)IA-VIIA
|
VIII族(1个)表中8、9、10三个纵行
零族(1个)表中最右列(稀有气体族)
同主族元素性质递变规律:从上到下,元素的金属性逐渐增强,非金属性逐渐减弱。
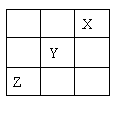 (10分)短周期元素X、Y、Z在元素周期表中的位置关系如右图.(1)X元素单质化学式为
,若X核内质子数与中子数相等,则X单质 的摩尔质量为
;
(10分)短周期元素X、Y、Z在元素周期表中的位置关系如右图.(1)X元素单质化学式为
,若X核内质子数与中子数相等,则X单质 的摩尔质量为
;