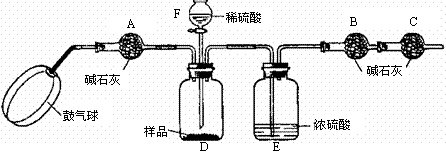
27.某研究性学习小组称取含NaCl的Na2CO3固体25g,将其配制成溶液,再向其中逐滴加入足量的7.3%的稀盐酸,使气体完全放出,共收集到 8.8gCO2气体。
(l)计算原固体中Na2CO3的质量分数和消耗盐酸的总质量。
(2)下表为研究性学习小组向上述配制的混合液中分三次逐滴加入(边加边振荡)盐酸后所记录的部分数据。经查阅资料知Na2CO3与HCl反应可以分两步进行:
Na2CO3 + HCl二NaCl+NaHCO3(I);NaHCO3 + HCl=NaCl + H2O+CO2↑(11)。
①请完成表格中未填的部分。
|
实验次数 |
每次产生的CO2的质量(g) |
|
第一次先逐滴加盐酸100g |
|
|
第二次再逐滴加盐酸100g |
8.8 |
|
第三次再逐滴加盐酸100g |
0 |
②根据表中数据在坐标系中画出CO2质量(纵坐标)与所加入盐酸质量(横坐标)的关系图。
 CO2
CO2
质量/g
25.(12分) 现在许多食品都采用密封包装,但包装袋中的空气、水蒸气仍会使食品氧化、受潮变质,因此一些食品包装袋中需放入一些脱氧剂,以使食品保质期更长一些。甲、乙、丙三同学为了探究“脱氧剂”的成分,从某食品厂的月饼包装袋中取出“脱氧剂”一袋,打开封口,将其倒在滤纸上,仔细观察,脱氧剂为灰黑色粉末,还有少量的红色粉末。
提出问题:该脱氧剂中的黑色、红色粉末各是什么?
猜想:甲同学认为:灰黑色粉末可能是氧化铜、红色粉末可能是铜。
乙同学认为:灰黑色粉末可能是铁粉,也可能还有少量的活性炭粉;红色物质是氧化铁。
丙同学认为:灰黑色物质可能是氧化铜、活性炭粉,红色粉末可能是铜。
(1)你认为 同学的猜想正确,其理由是:
。
(2)设计一个实验方案来验证该同学的猜想是正确的。请填写以下实验报告:
|
实验步骤 |
预期的实验现象 |
结论 |
|
① |
|
|
|
② |
|
|
(3)写出有关反应的化学方程式 ;
。