摘要:24.某纯碱样品中含有少量氯化钠.现欲测定其碳酸钠的质量分数.进行如下实验: [实验原理]Na2CO3+H2SO4 = Na2SO4 + H2O + CO2↑ 通过实验测定反应产生的二氧化碳的质量.即可求得原样品中碳酸钠的质量.进而求得碳酸钠在样品中的质量分数. [实验装置] [实验步骤] ①如图连接装置并加入所需药品. ②称量并记录B的质量(m1).(称量时注意封闭B的两端.) ⑧按动鼓气球.持续约1分钟. ④连接上B.C. ⑤打开分液漏斗F的活塞.将稀硫酸快速加入D中后.关闭活塞. ⑥按动鼓气球.持续约1分钟. ⑦称量并记录B的质量(m2).(称量时注意封闭B的两端及E右端的出口.) ⑧计算. ⑴已知碱石灰的主要成分是氢氧化钙和氢氧化钠.则干燥管A的作用: , 干燥管C的作用是 E装置的作用是 . 步骤③中鼓气的目的是 步骤⑥中鼓气的目的是 , 本实验能否同时省略③.⑥两个步骤? .原因是 . ⑵若所取样品的质量为5g.为确保实验顺利进行.分液漏斗F中至少要盛放10%的稀硫酸 mL.若m1为51.20g.m2为53.18g.样品中碳酸钠的质量分数为 .
网址:http://m.1010jiajiao.com/timu3_id_11735[举报]
某纯碱样品中含有少量氯化钠,现欲测定其碳酸钠的质量分数,进行如下实验:
实验原理:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数.
实验装置:
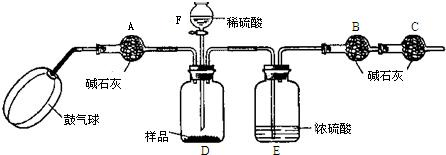
实验步骤:
①如图连接装置(除B、C外)并加入所需药品.
②称量并记录B的质量(m1).(称量时注意封闭B的两端.)
③按动鼓气球,持续约1分钟.
④连接上B、C.
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞.
⑥按动鼓气球,持续约1分钟.
⑦称量并记录B的质量(m2).(称量时注意封闭B的两端及E右端的出口.)
⑧计算.
(1)已知碱石灰的主要成分是氢氧化钙和氢氧化钠,则干燥管A的作用: ;
干燥管C的作用是
E装置的作用是 .
步骤③中鼓气的目的是
步骤⑥中鼓气的目的是 ;
本实验能否同时省略③、⑥两个步骤? ,原因是 .
(2)若所取样品的质量为5g,为确保实验顺利进行,分液漏斗F中至少要盛放10%的稀硫酸(密度为1.07g/mL) mL,若m1为51.20g,m2为53.18g,样品中碳酸钠的质量分数为 .
查看习题详情和答案>>
实验原理:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数.
实验装置:

实验步骤:
①如图连接装置(除B、C外)并加入所需药品.
②称量并记录B的质量(m1).(称量时注意封闭B的两端.)
③按动鼓气球,持续约1分钟.
④连接上B、C.
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞.
⑥按动鼓气球,持续约1分钟.
⑦称量并记录B的质量(m2).(称量时注意封闭B的两端及E右端的出口.)
⑧计算.
(1)已知碱石灰的主要成分是氢氧化钙和氢氧化钠,则干燥管A的作用:
干燥管C的作用是
E装置的作用是
步骤③中鼓气的目的是
步骤⑥中鼓气的目的是
本实验能否同时省略③、⑥两个步骤?
(2)若所取样品的质量为5g,为确保实验顺利进行,分液漏斗F中至少要盛放10%的稀硫酸(密度为1.07g/mL)
某纯碱样品中含有少量氯化钠,现欲测定其中碳酸钠的质量分数,进行如下实验:
〖实验原理〗Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得样品碳酸钠的质量分数.
〖实验装置〗

①如图所示连接装置,并检查气密性
②将10.0g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量为300.0g
④打开分液漏斗中的活塞,往试样溶液中滴入20%的稀硫酸,直至不再产生气泡为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量原盛有碱石灰的U型管的质量
⑦重复步骤⑤和⑥的操作,直至原盛有碱石灰的U型管的质量不再改变,测得质量为303.3g
回答下列问题:
(1)装置中NaOH溶液的作用是 ,写出该装置中发生反应的化学方程式 .
(2)浓硫酸的作用是 .
(3)从导管A处缓缓鼓入一定量的空气的目的是 ;
(4)B装置的作用是 ,
(5)该样品中碳酸钠的质量分数是 .
查看习题详情和答案>>
〖实验原理〗Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得样品碳酸钠的质量分数.
〖实验装置〗

①如图所示连接装置,并检查气密性
②将10.0g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量为300.0g
④打开分液漏斗中的活塞,往试样溶液中滴入20%的稀硫酸,直至不再产生气泡为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量原盛有碱石灰的U型管的质量
⑦重复步骤⑤和⑥的操作,直至原盛有碱石灰的U型管的质量不再改变,测得质量为303.3g
回答下列问题:
(1)装置中NaOH溶液的作用是
(2)浓硫酸的作用是
(3)从导管A处缓缓鼓入一定量的空气的目的是
(4)B装置的作用是
(5)该样品中碳酸钠的质量分数是
某纯碱样品中含有少量氯化钠,现欲测定其中碳酸钠的质量分数,进行如下实验:
〖实验原理〗Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得样品碳酸钠的质量分数.
〖实验装置〗
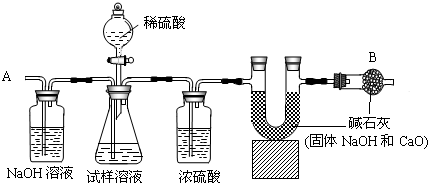
①如图所示连接装置,并检查气密性
②将10.0g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量为300.0g
④打开分液漏斗中的活塞,往试样溶液中滴入20%的稀硫酸,直至不再产生气泡为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量原盛有碱石灰的U型管的质量
⑦重复步骤⑤和⑥的操作,直至原盛有碱石灰的U型管的质量不再改变,测得质量为303.3g
回答下列问题:
(1)装置中NaOH溶液的作用是______,写出该装置中发生反应的化学方程式______.
(2)浓硫酸的作用是______.
(3)从导管A处缓缓鼓入一定量的空气的目的是______;
(4)B装置的作用是______,
(5)该样品中碳酸钠的质量分数是______.
查看习题详情和答案>>
某纯碱样品中含有少量氯化钠,现欲测定其碳酸钠的质量分数,进行如下实验:
【实验原理】Na2CO3+H2SO4===Na2SO4 + H2O + CO2↑ 通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数。
【实验装置】
【实验原理】Na2CO3+H2SO4===Na2SO4 + H2O + CO2↑ 通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数。
【实验装置】
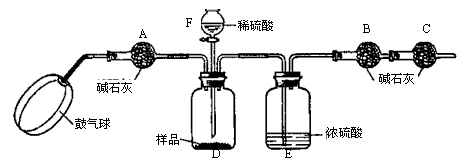
【实验步骤】
①如图连接装置(除B、C外)并加入所需药品。
②称量并记录B的质量(m1)。(称量时注意封闭B的两端。)
⑧按动鼓气球,持续约1分钟。
④连接上B、C。
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录B的质量(m2)。(称量时注意封闭B的两端及E右端的出口。)
⑧计算。
⑴已知碱石灰的主要成分是氧化钙和氢氧化钠,则干燥管A的作用: ;
干燥管C的作用是 ;
E装置的作用是 。
步骤③中鼓气的目的是 ;
步骤⑥中鼓气的目的是 ;
本实验能否同时省略③、⑥两个步骤? ,原因是 。
⑵若所取样品的质量为5g,为确保实验顺利进行,分液漏斗F中至少要盛放10%的稀硫酸(密度为1.07g/mL) mL,若m1为51.20g,m2为53.18g,样品中碳酸钠的质量分数为 。
查看习题详情和答案>>
①如图连接装置(除B、C外)并加入所需药品。
②称量并记录B的质量(m1)。(称量时注意封闭B的两端。)
⑧按动鼓气球,持续约1分钟。
④连接上B、C。
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录B的质量(m2)。(称量时注意封闭B的两端及E右端的出口。)
⑧计算。
⑴已知碱石灰的主要成分是氧化钙和氢氧化钠,则干燥管A的作用: ;
干燥管C的作用是 ;
E装置的作用是 。
步骤③中鼓气的目的是 ;
步骤⑥中鼓气的目的是 ;
本实验能否同时省略③、⑥两个步骤? ,原因是 。
⑵若所取样品的质量为5g,为确保实验顺利进行,分液漏斗F中至少要盛放10%的稀硫酸(密度为1.07g/mL) mL,若m1为51.20g,m2为53.18g,样品中碳酸钠的质量分数为 。
某纯碱样品中含有少量氯化钠,现欲测定其碳酸钠的质量分数,进行如下实验:
实验原理:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数.
实验装置:
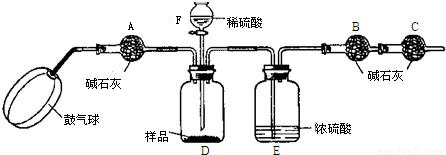
实验步骤:
①如图连接装置(除B、C外)并加入所需药品.
②称量并记录B的质量(m1).(称量时注意封闭B的两端.)
③按动鼓气球,持续约1分钟.
④连接上B、C.
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞.
⑥按动鼓气球,持续约1分钟.
⑦称量并记录B的质量(m2).(称量时注意封闭B的两端及E右端的出口.)
⑧计算.
(1)已知碱石灰的主要成分是氢氧化钙和氢氧化钠,则干燥管A的作用:______;
干燥管C的作用是______
E装置的作用是______.
步骤③中鼓气的目的是______
步骤⑥中鼓气的目的是______;
本实验能否同时省略③、⑥两个步骤?______,原因是______.
(2)若所取样品的质量为5g,为确保实验顺利进行,分液漏斗F中至少要盛放10%的稀硫酸(密度为1.07g/mL)______mL,若m1为51.20g,m2为53.18g,样品中碳酸钠的质量分数为______.
查看习题详情和答案>>
实验原理:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数.
实验装置:

实验步骤:
①如图连接装置(除B、C外)并加入所需药品.
②称量并记录B的质量(m1).(称量时注意封闭B的两端.)
③按动鼓气球,持续约1分钟.
④连接上B、C.
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞.
⑥按动鼓气球,持续约1分钟.
⑦称量并记录B的质量(m2).(称量时注意封闭B的两端及E右端的出口.)
⑧计算.
(1)已知碱石灰的主要成分是氢氧化钙和氢氧化钠,则干燥管A的作用:______;
干燥管C的作用是______
E装置的作用是______.
步骤③中鼓气的目的是______
步骤⑥中鼓气的目的是______;
本实验能否同时省略③、⑥两个步骤?______,原因是______.
(2)若所取样品的质量为5g,为确保实验顺利进行,分液漏斗F中至少要盛放10%的稀硫酸(密度为1.07g/mL)______mL,若m1为51.20g,m2为53.18g,样品中碳酸钠的质量分数为______.
查看习题详情和答案>>