河南省实验中学2008―2009学年上期期中试卷
高二年级 化学
( 时间:90分钟,满分110分)
相对原子质量:Cu 64 N 14 H 1
一、 选择题(每题只有一个正确答案,本题共20小题,每小题3分,共60分)
1.有关氮族元素的叙述错误的是
A、随着原子序数的增大,其原子半径也增大
B、都是典型的非金属元素
C、最高正价为+5价
D、气态氢化物的稳定性随原子序数的递增而降低
2.汽车排放的尾气中因含有氮的氧化物而污染大气,造成产生氮氧化物的主要原因是
A、在汽缸中N2被氧化 B、燃烧不充分
C、燃烧含铅汽油 D、燃烧含有氮化合物的燃料
3.鉴别NO2和溴蒸汽可用下列的
A、湿润的淀粉碘化钾 B、烧碱溶液
C、硝酸银溶液 D、湿润的蓝色石蕊试纸
4.可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是
A 3v正(N2)=v正(H2) B v正(N2)=v逆(NH3)
C 2v正(H2)=3v逆(NH3) D v正(N2)=3v逆(H2)
5.下列制取气体的方法在实验室不可取的是
①铜和稀硝酸反应排水法收集NO ②锌和稀硝酸反应制氢气
③氮气和氧气反应制NO ④加热氯化铵制取氨
A.①② B.②③ C. ②④ D. ②③④
6.以下物质的贮存方法正确的是
A.少量白磷贮存在二硫化碳中 B.氢氧化钠贮存在带玻璃塞的试剂瓶中
C.少量金属钠贮存在酒精中 D.AgNO3贮存在棕色试剂瓶中
7.硫代硫酸钠(Na2S2O3)与稀H2SO4溶液作用时发生如下反应:
Na2S2O3+H2SO4==Na2SO4+SO2+S+H2O 下列反应速率最大的是
B. 0.1molㄍL
Na2S2O3和0.1molㄍL H2SO4溶液各5mL,加水10mL,反应温度10
C. 0.2molㄍL
Na2S2O3和0.1molㄍL H2SO4溶液各5mL,加水10mL,反应温度30
D.0.2molㄍL
Na2S2O3和0.1molㄍL H2SO4溶液各5mL,加水5mL,反应温度30
8.反应
①v(A)=0.6mol?L-1?min-1 ②v(B)=0.45mol?L-1?min-1
③v(c)=0.4mol?L-1?min-1 ④v(D)=0.45mol?L-1?min-1
则反应速率最快的是
A.② B.③ C.① D.①②
9.下列事实中,不能应用化学平衡移动原理来解释的是
A.增大氧气的浓度有利于氨氧化的反应
B.700K左右比室温更有利于合成氨反应
C.开启啤酒瓶后,瓶中马上泛起大量泡沫
D.氨水应密闭低温保存
10.有关合成氨工业的说法中,正确的是
A.从合成塔出来的混合气体,其中NH3只占13―14%,所以生产氨的工厂的效率都很低
B.由于氨易液化,N2和H2是循环使用的,所以总体来说氨的产率很高
C.合成氨工业的反应温度控制在700K左右,目的是使化学平衡向正反应方向移动
D.合成氨采用的压强是2×107~5×107Pa,因该压强下铁触媒的活性最大
11.一密闭容器中反应mA(g)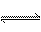 nB(g)+nC(g)达到平衡。保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍。则
nB(g)+nC(g)达到平衡。保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍。则
A.平衡向正反应方向移动 B.物质A的转化率增加
C. m>2n D.m<2n
12.在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:A(s)+2B(g) C(g)+D(g)已达到平衡状态的是
C(g)+D(g)已达到平衡状态的是
①混合气的压强 ②混合气的密度 ③气体的总物质的量
④混合气的平均分子量 ⑤混合气的总质量 ⑥B的物质的量浓度
A.①②④⑤ B.②④⑤⑥ C.②③⑤⑥ D.①②③④
13.是温度和压强对反应2Z(g) x+Y的影响示意图,图中横坐标表示温度,纵坐标表示平衡混合气体中z的体积分数。则下列叙述正确的是
x+Y的影响示意图,图中横坐标表示温度,纵坐标表示平衡混合气体中z的体积分数。则下列叙述正确的是
A.上述可逆反应的正反应△H<0
B.X、Y必须均为气态物质
C.若要提高Z的转化率,可向反应体系中加入合适的催化剂
D.若保持恒压,向平衡体系中通入He,正逆反应速率都不变
14.在一定温度和压强下,将一容积15mL的试管充满NO2后,倒置于一个盛水的水槽中。当试管内液面上升至一定高度不再变化时,在相同条件下再通入O2,若要使试管内液面仍保持在原高度,则应通入O2体积为
A.3.75mL B.7.5mL C.8.75mL D.10.5mL
15.一定条件下,在体积为 Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z,下列说法正确的是
A以X浓度变化表示的反应速率为0.001 mol/(L?s)
B将容器体积变为
C若增大压强,则物质Y的转化率减小
D若升高温度,X的体积分数增大,则该反应的DH>0
16. H++OH-;DH>0,下列叙述正确的是
H++OH-;DH>0,下列叙述正确的是
A向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B向水中加入少量固体硫酸氢钠,c(H+)增大,
C向水中加入少量H2SO4,平衡逆向移动,c(H+)降低
D将水加热,溶液的酸碱性不变,溶液的pH不变
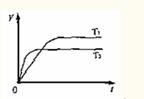 17.已知反应2SO2(g)+O2(g) 2SO3(g);△H<0。向某体积恒定的密闭容器中按体积比2:1充入SO2和O2,在一定条件下发生反应。右图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是
17.已知反应2SO2(g)+O2(g) 2SO3(g);△H<0。向某体积恒定的密闭容器中按体积比2:1充入SO2和O2,在一定条件下发生反应。右图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是
A.SO2的转化率 B.混合气体的密度
C.密闭容器内的原子数 D.O2的体积分数
18.在一定体积pH=1的HCl与HNO3的混合溶液中,逐滴加入 cmol.L-1的AgNO3溶液,当溶液中的Cl-恰好完全沉淀时,溶液PH=2。若反应后溶液的
体积等于反应前两溶液体积之和,则原溶液NO3―的物质的量浓度是
A.0.1cmol/L B.9cmol/L
C.(0.1
 19.一定温度下,在恒容密闭容器中发生如下反应:
19.一定温度下,在恒容密闭容器中发生如下反应:
A.1mol A 和1molB B.2molA、1molB和1molHe
C.1molB和1molC D.2molA、3molB和3molC
20.某100mL混合酸中,HNO3物质的量浓度为0.4mol/L,H2SO4物质的量浓度为0.2mol/L。向其中加入
A.0.15mol/L B. 0.3mol/L C.0.225mol/L D. 无法计算
二、填空题(共25分)
21.配平下列方程式:
(1)P+CuSO4+ H2O→Cu+H3PO4+H2SO4
(2)NH4NO3→N2+O2+ H2O
(3)Fe2++ ClO―+ H2O→Fe(OH)3+Fe3+ +Cl―
22.将4 mol SO2和2 mol O2混合置于体积可变的等压密闭容器中,在一定温度下发生如下反应2SO2(g)+O2(g) 2SO3(g);ΔH<0。该反应达到平衡状态时,测得气体的总物质的量为4.2 mol。试回答:
2SO3(g);ΔH<0。该反应达到平衡状态时,测得气体的总物质的量为4.2 mol。试回答:
(1)在该平衡状态时n(SO3)=______________________;
(2)若起始时加入1.2 mol SO2、0.6 mol O2和x mol SO3,达到平衡状态后,各气体的体积分数与上述平衡状态相同,x的取值为____________________________;
(3)若反应开始时的V (逆)> V(正),达到上述平衡状态时,气体的总物质的量仍为4.2 mol。则起始时n(SO3)的取值范围是________________________________。
23.羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,其常用的制备方法有两种:
方法A:用浓氨水分别调Ca(NO3)2和(NH4)2HPO4溶液的pH约为12;在剧烈搅拌下,将(NH4)2HPO4溶液缓慢滴入Ca(NO3)2溶液中。
方法B:剧烈搅拌下,将H3PO4溶液缓慢滴加到Ca(OH)2悬浊液中。
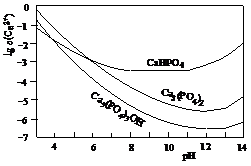
3种钙盐的溶解度随溶液pH的变化如上图所示(图中纵坐标是钙离子浓度的对数),回答下列问题:
(1)完成方法A和方法B中制备Ca5(PO4)3OH的化学反应方程式:
①5Ca(NO3)2+3(NH4)2HPO4+4NH3?H2O=Ca5(PO4)3OH↓+__________+_________
②5Ca(OH)2+3H3PO4=_________________________________________
(2)与方法A相比,方法B的优点是__________________________________________。
(3)方法B中,如果H3PO4溶液滴加过快,制得的产物不纯,其原因是________________________________________。
(4)图中所示3种钙盐在人体中最稳定的存在形式是______________________(填化学式)。
(5)糖黏附在牙齿上,在酶的作用下产生酸性物质,易造成龋齿。结合化学平衡移动原理,分析其原因________________
方案
反应物
甲
Cu、浓HNO3
乙
Cu、稀HNO3
丙
Cu、O2、稀HNO3
三、实验(共16分)
24.某兴趣小组设计出24图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
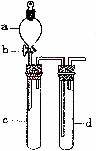
(24图)
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是 。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸。c中反应的化学方程式是 。再由a向c中加2 mL蒸馏水,c中的实验现象是 。
(3)题表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是 。理由是_____________。
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2。操作步骤为 ,实验现象为 ;但此实验的不足之处是 。
四、计算题(9分)
25.将N2和 H2按一定比例混合,在相同状况下其密度是H2的 3.6倍,取0.5mol该混合气体通入密闭容器内,使之发生反应并在一定条件下达到平衡。已知反应达到平衡后容器内压强是相同条件下反应前压强的0.76倍,试求:
(1)反应前混合气体中N2和 H2的体积比;
(2)达到平衡时混合气体中的氨的体积分数;
(3)平衡时N2的转化率。
高二年级 化学 答案
题号
1
2
3
4
5
6
7
8
9
10
答案
B
A
C
C
D
D
D
A
B
B
题号
11
12
13
14
15
16
17
18
19
20
答案
D
B
A
C
A
B
A
C
B
B
二、填空题(共25分)
21、
⑴ 2 5 8 5 2 5 ;
⑵ 2 2 1 4 ;
⑶ 6 3 3 2 4 3 。
22、(1)3.6 mol (2)≥0 (说明:答“任意值”可得分)
(3)3.6 mol< n (SO3)≤4 mol
23、(1)①10NH4NO3; 3H2O。 ②Ca5(PO4)3OH↓+9H2O。
(2)唯一副产物为水,工艺简单。
(3)反应液局部酸性过大,会有CaHPO4产生。 (4)Ca5(PO4)3OH。
(5)酸性物质使沉淀溶解平衡Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO43 -(aq)+OH-(aq)向右移动,
5Ca2+(aq)+3PO43 -(aq)+OH-(aq)向右移动,
导致Ca5(PO4)3OH溶解,造成龋齿
三、实验题(共16分)
24、(1)检查装置气密性。
(2)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
反应变缓,气体颜色变淡。
(3)丙; 耗酸量最少,无污染。
(4)向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸; c中有黄绿色气体产生,d中溶液变为黄棕; 没有处理尾气。
四、计算题(9分)
(1)解: ⑴0.5mol混合气体中:
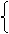
n(N2)+ n(H2) =0.5mol
n(N2)=0.1mol n(H2)=0.4mol V(N2):V(H2)= n(N2): n(H2) =1:4
⑵平衡后容器内压强是相同条件下反应前压强的0.76倍, 即平衡后容器内气体的物质的量是相同条件下反应前气体的物质的量的0.76倍
N2 + 3H2  2NH3
2NH3
起始/mol 0.1 0.4 0
变化/mol a
平衡/mol 0.1-a 0.4-
0.1-a+0.4-
平衡时 n(NH3)==0.12 mol
平衡时氨气的体积分数为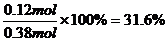
⑶平衡时的N2转化率=amol/0.1mol=60%