摘要:A.0.1molㄍL Na2S2O3和0.1molㄍL H2SO4溶液各5mL,加水5mL,反应温度10 0C
网址:http://m.1010jiajiao.com/timu_id_186902[举报]
某研究小组用如图所示装置探究SO2和Fe(NO3)3溶液反应的原理.
已知:1.0mol/LFe(NO3)3溶液的pH=1.请回答下列问题:
(1)装置A中发生反应的化学方程式是
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是
(3)装置B中产生了白色沉淀,其成分是
(4)分析B中产生白色沉淀的原因:
假设1:
假设2:SO2与Fe3+反应;
假设3:SO2与酸性条件下的N
反应.
①按假设2,装置B中反应的离子方程式是
②按假设3,只需将装置B中的Fe(NO3)3溶液替换成等体积的下列溶液,在相同条件下进行实验.应选择的试剂是
a.0.1mol/L稀硝酸
b.1.5mol/L Fe(NO3)2溶液
c.6.0mol/L NaNO3溶液和0.2mol/L盐酸等体积混合的溶液.
查看习题详情和答案>>

已知:1.0mol/LFe(NO3)3溶液的pH=1.请回答下列问题:
(1)装置A中发生反应的化学方程式是
Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O
Na2SO3+H2S04(浓)=Na2S04+SO2↑+H2O
.(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是
打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹
打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹
.(3)装置B中产生了白色沉淀,其成分是
BaS04
BaS04
,说明SO2具有性还原性
还原性
.(4)分析B中产生白色沉淀的原因:
假设1:
SO2和Fe3+、酸性条件下NO3-都反应
SO2和Fe3+、酸性条件下NO3-都反应
;假设2:SO2与Fe3+反应;
假设3:SO2与酸性条件下的N
| O | - 3 |
①按假设2,装置B中反应的离子方程式是
SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+
SO2+2Fe3++Ba2++2H2O=BaSO4↓+2Fe2++4H+
.②按假设3,只需将装置B中的Fe(NO3)3溶液替换成等体积的下列溶液,在相同条件下进行实验.应选择的试剂是
c
c
(填序号).a.0.1mol/L稀硝酸
b.1.5mol/L Fe(NO3)2溶液
c.6.0mol/L NaNO3溶液和0.2mol/L盐酸等体积混合的溶液.
某反应:2A(g) 3B(g)的各物质的浓度隨时间变化如图所示,则有关反应速率表示正确的是
3B(g)的各物质的浓度隨时间变化如图所示,则有关反应速率表示正确的是
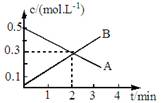
A、v(A)=0.1mol/(L.min) B、v(B)=0.2mol/(L.min)
C、v(A)= v(B) =0.5 mol/(L.min) D、v(A)= v(B) =0.3 mol/(L.min)
查看习题详情和答案>>