摘要:(1)解: ⑴0.5mol混合气体中:
网址:http://m.1010jiajiao.com/timu_id_186942[举报]
对于0.5mol/L Fe2(SO4)3和0.5mol/L CuSO4的混合溶液100mL,可用下列两种方法进行分离、提纯和转化.
方法1、用下图所示的流程进行分离,同时获得硫酸亚铁晶体和铜粉.
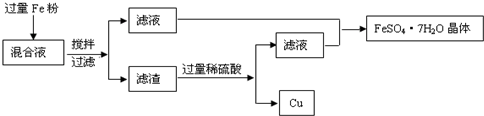
请回答:
(1)由滤液制取FeSO4?7H2O晶体要经过
(2)用100mL的混合液制取FeSO4?7H2O晶体,制得的晶体质量至少
方法2、用纸层析方法进行分离,实验步骤如下:
①点样:如右图所示,在滤纸条末端约2cm处用铅笔画一个小圆点作为原点.
在原点处滴一滴Fe2(SO4)3和CuSO4的混合溶液.晾干后再滴,重复3次,要求留下斑点的直径小于0.5cm.将滤纸条用大头针固定在橡胶塞下面.
②展开:在大试管中加入9mL丙酮和1mL 3mol?L-1硫酸,混合均匀.把滤纸末端浸入溶剂中约0.5cm,注意不要让试样点接触展开剂.塞紧橡胶塞,将大试管垂直静置.
③显色:待溶剂扩散到滤纸上端时,取下滤纸,放在盛有浓氨水的试剂瓶瓶口上方,用氨气熏.请回答:
(3)硫酸的作用是
(4)氨熏后红棕色出现在滤纸上端,其原因是
查看习题详情和答案>>
方法1、用下图所示的流程进行分离,同时获得硫酸亚铁晶体和铜粉.

请回答:
(1)由滤液制取FeSO4?7H2O晶体要经过
加热蒸发
加热蒸发
、冷却结晶
冷却结晶
、过滤、洗涤等步骤,要想加快过滤的速度可以通过抽滤的方法,则抽滤要用到的主要仪器是布氏漏斗、吸滤瓶
布氏漏斗、吸滤瓶
.(2)用100mL的混合液制取FeSO4?7H2O晶体,制得的晶体质量至少
55.6
55.6
g.方法2、用纸层析方法进行分离,实验步骤如下:

①点样:如右图所示,在滤纸条末端约2cm处用铅笔画一个小圆点作为原点.
在原点处滴一滴Fe2(SO4)3和CuSO4的混合溶液.晾干后再滴,重复3次,要求留下斑点的直径小于0.5cm.将滤纸条用大头针固定在橡胶塞下面.
②展开:在大试管中加入9mL丙酮和1mL 3mol?L-1硫酸,混合均匀.把滤纸末端浸入溶剂中约0.5cm,注意不要让试样点接触展开剂.塞紧橡胶塞,将大试管垂直静置.
③显色:待溶剂扩散到滤纸上端时,取下滤纸,放在盛有浓氨水的试剂瓶瓶口上方,用氨气熏.请回答:
(3)硫酸的作用是
抑制Cu2+和Fe3+的水解
抑制Cu2+和Fe3+的水解
;在层析操作时,不让滤纸上的试样点接触展开剂的原因是如果试样接触展开剂,样点里要分离的离子或者色素就会进入展开剂,导致实验失败
如果试样接触展开剂,样点里要分离的离子或者色素就会进入展开剂,导致实验失败
.(4)氨熏后红棕色出现在滤纸上端,其原因是
Fe3+更易溶于丙酮,展开的速度快
Fe3+更易溶于丙酮,展开的速度快
,由色斑的形成和距离
色斑的形成和距离
可判断分离的效果.Ⅰ、CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气.
(1)已知某反应的平衡常数表达式为:K=
,它所对应的化学方程式为:______.
(2)向体积为2L的密闭容器中充入CH4和H2O(g)组成的混合气(共1mol),在一定条件下发生反应,并达到平衡状态,测得温度、压强、投料比X〔
)对该反应的影响如图所示.

①图1中的两条曲线所示投料比的关系X2______X1(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:P2______P1
(3)以CH4、O2为原料可设计成燃料电池:
①设装置中盛有150.0mL1.0mol/LKOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,放电过程中转移电子的物质的量为______.
②以H2SO4溶液代替KOH溶液为电解质溶液,则燃料电池的负极反应式为:______.
Ⅱ、(1)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-akJ?mol-1;
CH3OH(g)═CH3OH(l)△H=-bkJ?mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-ckJ?mol-1;
H2O(g)═H2O(l)△H=-dkJ?mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:______.
(2)已知某温度下Mg(OH)2的Ksp=6.4xl0-12,当溶液中c(Mg2+)≤1.0×10-5mol?L-1可视为沉淀完全,则应保持溶液中c(OH-)≥______mol?L-1.
查看习题详情和答案>>
(1)已知某反应的平衡常数表达式为:K=
| c(H2)?c(CO) |
| c(H2O) |
(2)向体积为2L的密闭容器中充入CH4和H2O(g)组成的混合气(共1mol),在一定条件下发生反应,并达到平衡状态,测得温度、压强、投料比X〔
| n(CH4) |
| n(H2O) |

①图1中的两条曲线所示投料比的关系X2______X1(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:P2______P1
(3)以CH4、O2为原料可设计成燃料电池:
①设装置中盛有150.0mL1.0mol/LKOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,放电过程中转移电子的物质的量为______.
②以H2SO4溶液代替KOH溶液为电解质溶液,则燃料电池的负极反应式为:______.
Ⅱ、(1)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-akJ?mol-1;
CH3OH(g)═CH3OH(l)△H=-bkJ?mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-ckJ?mol-1;
H2O(g)═H2O(l)△H=-dkJ?mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:______.
(2)已知某温度下Mg(OH)2的Ksp=6.4xl0-12,当溶液中c(Mg2+)≤1.0×10-5mol?L-1可视为沉淀完全,则应保持溶液中c(OH-)≥______mol?L-1.
![]() 和
和![]() 的混合溶液中,c
的混合溶液中,c![]() 为
为![]() ,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中。
,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中。![]() 为
为
[ ]
A.0.5mol·
B.1mol·
C.1.5mol·
D.2mol.