网址:http://m.1010jiajiao.com/timu_id_186914[举报]
 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1⑴生产中为提高反应速率和SO2的转化率,下列措施可行的是_______(填字母,下同)。
A.向装置中充入N2
B.向装置中充入过量的SO2
C.向装置中充入O2
D.升高温度
⑵若在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2 和2mol O2 及固体催化剂,发生上述反应,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g) ,下列说法正确的是___________
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
⑶生产中在550 ℃时,将2.0 mol SO2和1.0 mol O2置于 5 L密闭容器中,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。反应达平衡后,体系总压强为
0.10 M Pa。试计算反应 2SO3
 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。 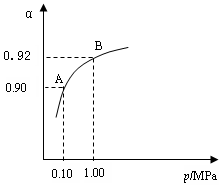
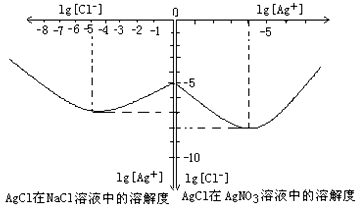
①由图知该温度下AgCl的溶度积常数为__________________________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:__________________________
 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1⑴生产中为提高反应速率和SO2的转化率,下列措施可行的是_______(填字母,下同)。
A.向装置中充入N2
B.向装置中充入过量的SO2
C.向装置中充入O2
D.升高温度
⑵若在一定温度下,向一个容积可变的恒压容器中,通入3mol SO2 和2mol O2 及固体催化剂,发生上述反应,平衡时容器内气体体积为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g) ,下列说法正确的是___________
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于2/9
⑶生产中在550 ℃时,将2.0 mol SO2和1.0 mol O2置于 5 L密闭容器中,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。反应达平衡后,体系总压强为
0.10 M Pa。试计算反应 2SO3
 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。 
①由图知该温度下AgCl的溶度积常数为__________________________。
②AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:__________________________

|
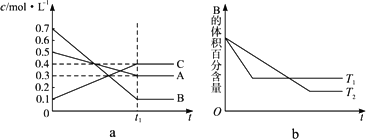
T ℃时,在容积恒定的密闭容器中A气体与B气体反应生成C气体,反应过程中A、B、C浓度的变化如下图a所示,若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如下图b所示,则下列结论正确的是
| |
A. |
其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 |
B. |
T ℃时,若在该容器中由0.4 mol·L-1 A、0.4 mol·L-1 B和0.2 mol·L-1 C反应,达到平衡后,C的浓度仍为0.4 mol·L-1 |
C. |
在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 |
D. |
(t1+10)min时,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
 H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表: 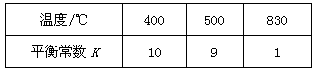
(2)在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述第II步反应,达到平衡后下列关系正确的是________________
(3)在一个绝热等容容器中,不能判断此流程的第II步反应达到平衡的是____________ 。
①体系的压强不再发生变化 ②混合气体的密度不变 ③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变 ⑤体系的温度不再发生变化 ⑥v(CO2)正=v(H2O)逆
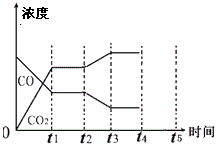
(4)下图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是______________、_______________(写出两种)。若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变)。
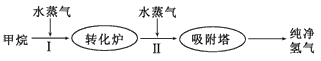
(14分)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图:
(1)此流程的第II步反应为:CO(g)+H2O(g)H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
从上表可以推断:此反应是 (填“吸”或“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入1mo1CO和2mo1H2O,则达到平衡后CO的转化率为 。
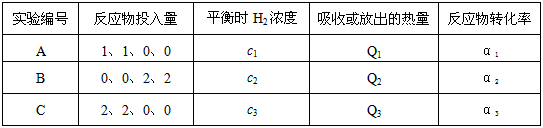
(2)在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述第II步反应,达到平衡后下列关系正确的是
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1[来源:] |
| B | 0、0、2、2 | c2 | Q2 | α2
|
| C | 2、2、0、0 | c3 | Q3 | α3 |
A.2c1= c2 =c3 B.2Q1=Q2=Q3 C.α1 =α2 =α3 D.α1 +α2 =1
(3)在一个绝热等容容器中,不能判断此流程的第II步反应达到平衡的是 。
①体系的压强不再发生变化 ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化 ⑥v(CO2)正=v(H2O)逆
(4)下图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是 、
(写出两种)。若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变)。
查看习题详情和答案>>