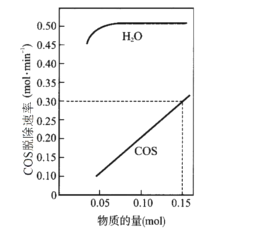
【题目】硫及其化合物有许多用途。相关物质的物理常数如表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______,基态S原子电子占据最高能级的电子云轮廓图为______形。
(2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是______。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为____。
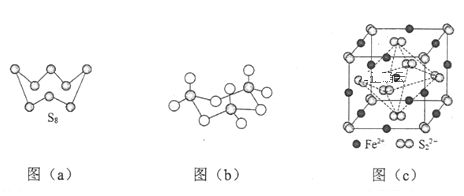
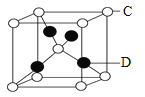
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为______形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子。该分子中S原子的杂化轨道类型为______。
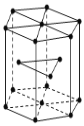
(5)FeS2晶体的晶胞如图(c)所示,该晶胞中FeS2个数___________,晶胞边长为anm,FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_____g/cm3.(写出表达式) ;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长为______nm。
【题目】Cu、Zn及其化合物在生产、生活中有着重要作用。
(1)Cu、Zn在周期表中__区,焰色反应时Cu的4s电子会跃迁至4p轨道,写出Cu的激发态电子排布式_。
(2)分别向CuSO4、MgSO4溶液加氨水至过量,前者为深蓝色溶液,后者为白色沉淀。
①NH3与Cu2+形成配合物的能力大于Mg2+的原因是__。
②溶液中的水存在H3O+、H5O2+等微粒形式,H5O2+可看作是H3O+与H2O通过氢键形成的离子,则H5O2+的结构式是__。
(3)Zn的某种化合物M是很好的补锌剂,结构式如图:
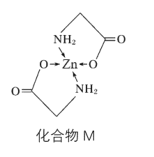
①1molM含有的σ键的数目为__。
②常见含N的配体有H2NCH2COO-、NH3、N3-等,NH3的分子空间构型为__,N3-的中心N原子杂化方式为__。
③M在人体内吸收率高的原因可能是锌形成螯合物后,电荷__(填“变多”“变少”或“不变”),可在消化道内维持良好的稳定性。
(4)卤化锌的熔点如表:
卤化锌/ZnX2 | ZnF2 | ZnCl2 | ZnBr2 | ZnI2 |
熔点/℃ | 872 | 283 | 394 | 445 |
则ZnX2熔点如表变化的原因是__。
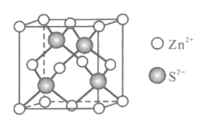
(5)Zn的某种硫化物的晶胞如图所示。已知晶体密度为dgcm-3,且S2-、Zn2+相切,则Zn2+与S2+的核间距为__nm(写计算表达式)。