题目内容
【题目】A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是________(用对应的元素符号表示);基态D原子的价电子排布式为______________________。
(2)A的最高价氧化物分子中,其中心原子采取________杂化;BC3-的立体构型为________(用文字描述)。
(3)1 mol AB-中含有的π键个数为________。
(4)化合物CH3COO[Cu(NH3)3·CO]中与Cu+形成配离子的配体为____________(填化学式)。
(5) CH3COOH中C原子杂化轨道类型为_________________。
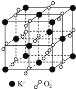
(6)元素D与元素C形成一种化合物其晶胞结构如图所示,该化合物的化学式为______.
【答案】C<O<N 1s22s22p63s23p63d104s1 sp 平面三角形 2NA NH3和CO sp3、sp2 Cu2O
【解析】
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大;第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,则A是C元素;C是地壳中含量最多的元素,则C是O元素;B原子的最外层p轨道的电子为半充满结构,且原子序数大于A而小于C,则B是N元素;D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,则D是Cu元素,据此分析解题。
由分析知:A为C元素、B为N元素、C为O元素、D是Cu元素;
(1)同一周期元素,元素第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以C、N、O元素第一电离能从小到大顺序是C<O<N;基态D原子核外有29个电子,根据构造原理可知基态Cu原子的电子排布式为1s22s22p63s23p63d104s1;
(2)A的最高价氧化物为CO2,C和O形成2个δ键,没有孤电子对,为直线形结构,C原子采取sp方式杂化;NO3-中心原子N价层电子对个数=3+![]() =3,且不含孤电子对,为sp2杂化,立体构型为平面三角形;
=3,且不含孤电子对,为sp2杂化,立体构型为平面三角形;
(3)CN-与N2互为等电子体,则每个CN-中含有2个π键,则1mol CN-中含有的π键个数为2NA;
(4) 化合物CH3COO[Cu(NH3)3CO]中与Cu+形成配离子的配体为NH3和CO;
(5) CH3COOH中CH3-上的C原子形成4个共价键,则采用sp3杂化,羧基上碳原子形成3个共价键,且无孤对电子,则采用sp2杂化;
(6)元素D为Cu,晶胞中Cu个数为4,C元素为O,O原子个数为8×![]() +1=2,Cu与O的原子数目比为4:2=2:1,则该化合物的化学式为Cu2O。
+1=2,Cu与O的原子数目比为4:2=2:1,则该化合物的化学式为Cu2O。

【题目】硫及其化合物有许多用途。相关物质的物理常数如表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______,基态S原子电子占据最高能级的电子云轮廓图为______形。
(2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是______。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为____。
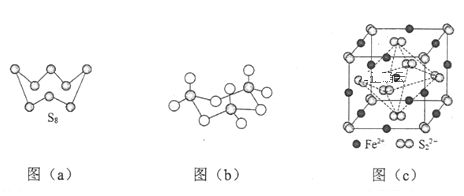
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为______形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子。该分子中S原子的杂化轨道类型为______。
(5)FeS2晶体的晶胞如图(c)所示,该晶胞中FeS2个数___________,晶胞边长为anm,FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_____g/cm3.(写出表达式) ;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长为______nm。