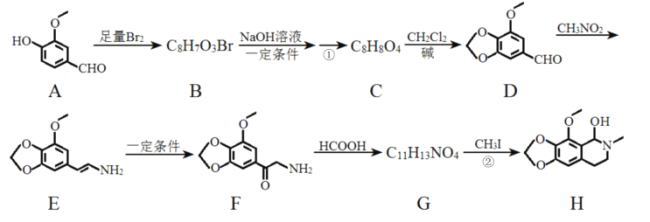
题目内容
【题目】如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
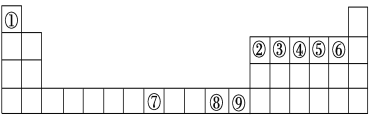
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,⑨元素位于周期表的________区。
(2)④、⑥两元素形成的化合物的立体构型为________,其中心原子的杂化轨道类型为________。
(3)元素⑧的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为________。
(4)在周期表给出的9种元素中,电负性最大的元素基态原子的电子排布式为___________。
(5)在①与④形成的相对分子质量最小的化合物A中,元素④的杂化类型是____,写出与化合物A互为等电子体的一种阳离子______(填离子符号)。
(6)关于元素①与元素⑤形成的1︰1的化合物,下列说法正确的是______(填字母序号)。
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1︰1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(7)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于________晶体(填晶体类型),化合物中⑦的化合价为:_______。根据等电子体理论,该化合物的配体的结构式为:_______,CaC2中,阴离子的电子式为: ____________________。
【答案】ds 三角锥形 sp3 配位键 1s22s22p5; sp3 H3O+ C 分子 0 ![]()

【解析】
根据元素周期表的位置,①为H、②为B、③为C、④为N、⑤为O、⑥为F、⑦为Fe、⑧为Cu、⑨为Zn;
(1)⑨为Zn元素,其价电子排布式为3d104s2;
(2) ④为N元素,⑥为F元素,两元素形成的化合物为NF3,N原子的价层电子对个数=3+![]() =4,其中孤电子对数为1;
=4,其中孤电子对数为1;
(3)元素⑧为Cu,Cu(OH)2溶于氨水,生成配离子[Cu(NH3)4]2+;
(4)元素的非金属性越强,电负性越大,则①~⑨中氟元素的电负性最大,其核电荷数为9;
(5) ①为H、④为N,两元素形成的相对分子质量最小的化合物为NH3,N原子的价层电子对个数=3+![]() =4,其中孤电子对数为1;
=4,其中孤电子对数为1;
(6)①⑤形成的原子数为1:1的物质是H2O2.其结构式为H-O-O-H,含有极性键,是极性分子;
(7)元素⑦与CO可形成的Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,熔沸点低,易溶于非极性溶剂,属于分子晶体;在Fe(CO)5在C元素为+2价,O为-2价,结合正负化合价代数和为0可知,Fe元素的化合价为0;CO和N2、![]() 均为等电子体,结合N2的结构写出CO的结构和
均为等电子体,结合N2的结构写出CO的结构和![]() 的电子式。
的电子式。
根据元素周期表的位置,①为H、②为B、③为C、④为N、⑤为O、⑥为F、⑦为Fe、⑧为Cu、⑨为Zn;
(1) ⑨为Zn元素,其价电子排布式为3d104s2,则锌元素位于周期表的ds区;
(2) ④为N元素,⑥为F元素,两元素形成的化合物为NF3,N原子的价层电子对个数=3+![]() =4,其中孤电子对数为1,则N原子的杂化轨道类型为sp3,NF3的立体构型为三角锥形;
=4,其中孤电子对数为1,则N原子的杂化轨道类型为sp3,NF3的立体构型为三角锥形;
(3) 元素⑧为Cu,Cu(OH)2溶于氨水,生成配离子[Cu(NH3)4]2+,,Cu2+离子与NH3间结合的作用力为配位键;
(4)元素①~⑨中氟元素的电负性最大,其核电荷数为9,基态氟原子的电子排布式为1s22s22p5;
(5) ①为H、④为N,两元素形成的相对分子质量最小的化合物为NH3,N原子的价层电子对个数=3+![]() =4,其中孤电子对数为1,则N原子的杂化类型是sp3,与NH3互为等电子体的一种阳离子为H3O+;
=4,其中孤电子对数为1,则N原子的杂化类型是sp3,与NH3互为等电子体的一种阳离子为H3O+;
(6)①⑤形成的原子数为1:1的物质是H2O2,其结构式为H-O-O-H;
A.分子中含有氢原子,氢原子达到2e-稳定结构,不是8e-,故A错误;
B.分子中不含π键,故B错误;
C.分子中H-O为极性键,O-O键为非极性键,H2O2为极性分子,故C正确;
D.H2O2分子中O原子是sp3杂化,则分子立体构型不是直线形结构,故D错误;
故答案为:C;
(7)元素⑦与CO可形成的Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,熔沸点低,易溶于非极性溶剂,属于分子晶体,根据等电子体理论,CO和N2、![]() 均为等电子体,N2分子的电子式为
均为等电子体,N2分子的电子式为![]() ,则CO的结构式为
,则CO的结构式为![]() ,
,![]() 的电子式为
的电子式为 。
。

 53随堂测系列答案
53随堂测系列答案