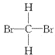
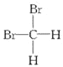
题目内容
【题目】常温下,向20mL0.1molL-1NH4HSO4溶液中逐滴加入0.1molL-1的NaOH溶液,溶液中由水电离出的c水(H+)与所加NaOH溶液的体积的关系如图所示。下列分析正确的是( )
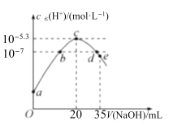
A.c点之前,主要的反应为NH4++OH-═NH3H2O
B.b点和d点对应溶液的pH均为7
C.常温下,Kb(NH3H2O)=5×10-5.4molL-1
D.d点溶液中,c(Na+)+c(NH4+)=c(SO42-)
【答案】C
【解析】
向NH4HSO4溶液中逐滴加入NaOH溶液,a到c点先发生酸碱中和生成硫酸铵和硫酸钠,硫酸氢铵以电离为主显酸性,抑制水的电离;转化成硫酸铵的过程中对水电离的抑制逐渐减弱,完全转化成硫酸铵时,即c点,硫酸铵水解显酸性,对水电离起促进作用;当加入稍过量的氢氧化钠时,即d点,溶液中有硫酸铵的水解和氢氧化钠的电离,溶液显中性;当再过量的氢氧化钠时,主要以氢氧化钠的电离为主显碱性,抑制水的电离。
A.NH4HSO4和NaOH溶液混合时先发生中和反应,再生成弱电解质NH3H2O,酸或碱抑制水电离,(NH4)2SO4促进水电离,c点溶质为硫酸钠、硫酸铵,c点前发生的是中和反应,离子方程式为H++OH-═H2O,故A错误;
B.b点溶质为NH4HSO4、Na2SO4、(NH4)2SO4,c点溶质为Na2SO4、(NH4)2SO4,d点溶质为Na2SO4、(NH4)2SO4、NH3H2O,所以b和c点呈酸性、d点呈中性,故B错误;
C.当加入20mLNaOH溶液时,溶质为(NH4)2SO4,铵根离子水解产生的c(H+)=1.0×10-5.3mol/L,Kb(NH3H2O)=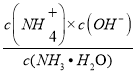 =
=![]() =5×10-5.4,故C正确;
=5×10-5.4,故C正确;
D.d点溶质为Na2SO4、(NH4)2SO4、NH3H2O,溶液呈中性,则c(H+)=c(OH-),溶液中存在电荷守恒c(Na+)+c(NH4+)+c(H+)=c(OH-)+2c(SO42-),所以c(Na+)+c(NH4+)=2c(SO42-),故D错误;
故选:C。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案