题目内容
【题目】硫及其化合物有许多用途。相关物质的物理常数如表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______,基态S原子电子占据最高能级的电子云轮廓图为______形。
(2)根据价层电子对互斥理论,H2S,SO2,SO3的气态分子中,中心原子价层电子对数不同于其他分子的是______。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为____。
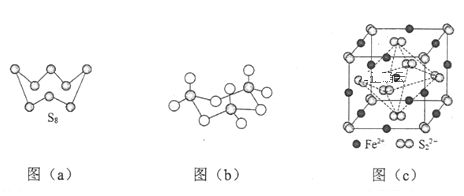
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为______形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子。该分子中S原子的杂化轨道类型为______。
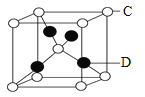
(5)FeS2晶体的晶胞如图(c)所示,该晶胞中FeS2个数___________,晶胞边长为anm,FeS2相对式量为M、阿伏加德罗常数的值为NA,其晶体密度的计算表达式为_____g/cm3.(写出表达式) ;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长为______nm。
【答案】![]() 哑铃 H2S S8与SO2都是分子晶体,S8相对分子质量比SO2大,S8的分子间作用力大于SO2,所以熔沸点S8>SO2 平面正三角 2 sp3 4
哑铃 H2S S8与SO2都是分子晶体,S8相对分子质量比SO2大,S8的分子间作用力大于SO2,所以熔沸点S8>SO2 平面正三角 2 sp3 4 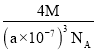
![]() a
a
【解析】
(1)基态Fe原子价层电子为其3d、4s能级上电子;基态S原子电子占据的能级有1s、2s、2p、3s、3p,最高能级为3p,其电子云轮廓图为哑铃形;
(2)H2S中S原子价层电子对个数=2+![]() =4、SO2中S原子价层电子对个数=2+
=4、SO2中S原子价层电子对个数=2+![]() =3、SO3中S原子价层电子对个数=3+
=3、SO3中S原子价层电子对个数=3+![]() =3;
=3;
(3)S8、SO2都分子晶体,分子晶体熔沸点与其分子间作用力成正比,分子间作用力与其相对分子质量成正比;
(4)SO3中S原子价层电子对个数=3+![]() =3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型;该分子中S-O原子之间存在共价键;该分子中每个S原子价层电子对个数都是4,根据价层电子对互斥理论判断S原子杂化类型;
=3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型;该分子中S-O原子之间存在共价键;该分子中每个S原子价层电子对个数都是4,根据价层电子对互斥理论判断S原子杂化类型;
(5)晶胞边长为anm=a×10-7cm,晶胞体积=(a×10-7cm)3,该晶胞中Fe2+个数=1+12×![]() =4,S22-个数=8×
=4,S22-个数=8×![]() +6×
+6×![]() =4,其晶体密度=
=4,其晶体密度=![]() ;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长根据正方形对角线的长度计算。
;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长根据正方形对角线的长度计算。
(1)基态Fe原子的核外价电子排布式为[Ar]3d64S2,基态Fe原子价层电子为其3d、4s能级上电子,则基态Fe原子的核外价电子排布图为![]() ;基态S原子电子占据的能级有1s、2s、2p、3s、3p,最高能级为3p,其电子云轮廓图为哑铃形;
;基态S原子电子占据的能级有1s、2s、2p、3s、3p,最高能级为3p,其电子云轮廓图为哑铃形;
(2)H2S中S原子价层电子对个数=2+![]() =4、SO2中S原子价层电子对个数=2+
=4、SO2中S原子价层电子对个数=2+![]() =3、SO3中S原子价层电子对个数=3+
=3、SO3中S原子价层电子对个数=3+![]() =3,中心原子价层电子对数不同于其他分子的是H2S;
=3,中心原子价层电子对数不同于其他分子的是H2S;
(3)S8、SO2都分子晶体,分子晶体熔沸点与其分子间作用力成正比,分子间作用力与其相对分子质量成正比,S8相对分子质量大于SO2,所以分子间作用力S8大于SO2,导致熔沸点S8大于O2;
(4)SO3中S原子价层电子对个数=3+![]() =3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为平面正三角形;该分子中S-O原子之间存在σ和离域大π键,所以共价键类型2种;该分子中每个S原子价层电子对个数都是4,根据价层电子对互斥理论判断S原子杂化类型为sp3;
=3,且不含孤电子对,根据价层电子对互斥理论判断其空间构型为平面正三角形;该分子中S-O原子之间存在σ和离域大π键,所以共价键类型2种;该分子中每个S原子价层电子对个数都是4,根据价层电子对互斥理论判断S原子杂化类型为sp3;
(5)该晶胞中Fe2+个数=1+12×![]() =4,S22-个数=8×
=4,S22-个数=8×![]() +6×
+6×![]() =4,该晶胞中FeS2个数为4;晶胞边长为anm=a×10-7cm,晶胞体积=(a×10-7cm)3,则晶体密度=
=4,该晶胞中FeS2个数为4;晶胞边长为anm=a×10-7cm,晶胞体积=(a×10-7cm)3,则晶体密度=![]() =
=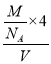 =
=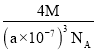 g/cm3;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长=
g/cm3;晶胞中Fe2+位于S22-所形成的八面体的体心,该正八面体的边长=![]() ×
×![]() ×anm=
×anm=![]() anm。
anm。

 优加精卷系列答案
优加精卷系列答案【题目】有U、V、W、X四种前三周期元素,原子序数依次增大,其相关信息如下表:
元素编号 | 相关信息 |
U | 所处的周期数、族序数分别与其原子序数相等 |
V | 外层电子数是最内层电子数的两倍 |
W | 单质中有三对共用电子对 |
X | 是地壳中含量最多的元素 |
请回答下列问题:
(1)U、V两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子的空间构型为________。
(2)写出W单质的结构式 ___________,其化学键为________性共价键:W最简单气态氢化物的电子式为___________,分子的空间构型是___________,其化学键为___________性共价键。
(3)X在周期表中的位置是_______,该主族元素的气态氢化物中,沸点最低的是__________(填化学式)
(4)乙和丙分别是V和X的某种氢化物,这两种氢化物分子中含有有18个电子。乙和丙的化学式分别是________、________。
【题目】元素周期表是指导化学学习的重要工具。下图为元素周期表的一部分。请按要求填空:
N | O | F | |||||
Mg | Al | S | Cl | ||||
(1)N元素形成的单质的电子式_________;N元素的气态氢化物含有化学键属于_______(“离子键”或“共价键”)。
(2)Mg和Al中,金属性较强的是_______(写元素符号),写出一条能说明该结论的事实(用文字描述)___________
(3)S和Cl中,非金属性较强的是___________(写元素符号),不能说明该结论的事实是________(填字母符号)。
a. 单质硫难溶于水,氯气能溶于水
b. ![]() 通入
通入![]() 溶液中,溶液变浑浊
溶液中,溶液变浑浊
c. 受热时![]() 易分解,HCl不易分解
易分解,HCl不易分解
d. 氯气与铁反应生成![]() ,硫与铁反应生成FeS
,硫与铁反应生成FeS
(4)O和S中,非金属性较强的是_________(写元素符号),写出能说明该结论的化学方程式______________
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制环己烯。
已知:![]()
密度( | 熔点℃ | 沸点℃ | 溶解性 | |
环己醇 | 0.096 | 25 | 161 | 能溶于水 |
环己烯 | 0.081 | -103 | 83 | 难溶于水 |
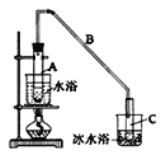
制备粗品:
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
(1)A中瓷片的作用是______,导管B除了导气外还具有的作用是______;
(2)试管C置于冰水浴中的目的是__________________________。
制备精品:
(3)环己烯粗品中含有环己醇和少量酸性杂质等。加入少量食盐水,振荡、静置、分层,环己烯在_______层(填“上”或“下”),分液后用_________(填入编号)洗涤;
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
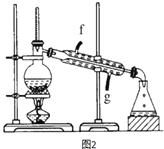
(4)再将环己烯按图2装置蒸馏,冷却水从_______(填f或g)口进入,蒸馏时要加入生石灰,目的是______________。收集产品时,温度应控制在_____左右。
(5)以下区分环己烯精品与粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
若用上述装置制备乙酸乙酯,回答下列问题。
(6)用分液漏斗提纯试管C中的乙酸乙酯,在操作时要注意振荡洗涤后,静置分液前必须放气,具体操作方法是__________(填编号)
a.将仪器正放在架子或铁圈上打开上部塞子
b.将仪器正放在架子或铁圈上打开活塞
c.用手心抵住仪器上部塞子倒置后打开活塞
d.将该仪器平放在实验台上打开活塞
(7)所制得的酯应从该分液漏斗的__________(填编号)
a.下部流出 b.上口倒出 c.都可以
(8)在提纯乙酸乙酯时,为什么要使用饱和碳酸钠溶液,而不用NaOH溶液洗涤?
______________________________________。