题目内容
【题目】羰基硫(COS)主要存在于煤、石油和天然气中,会造成设备腐蚀、环境污染,更危害人体健康。目前,我国已经实现了在催化剂(γ-Al2O3)、低温条件下的精度脱除COS,如图为天然气中脱除COS反应流化床示意图:
(1)①已知:H2(g)+COS(g)![]() H2S(g)+CO(g) △H1=+6.2kJmol-1
H2S(g)+CO(g) △H1=+6.2kJmol-1
H2(g)+CO2(g)![]() H2O(g)+CO(g) △H2=+41.2kJmol-1
H2O(g)+CO(g) △H2=+41.2kJmol-1
则COS精度脱除反应H2O(g)+COS(g)![]() H2S(g)+CO2(g)的△H=__kJmol-1。
H2S(g)+CO2(g)的△H=__kJmol-1。
②将H2O与COS以体积比1:2置于恒温恒容密闭容器中反应,若测得该反应平衡时H2O与COS的体积比1:6,则该温度下,脱除反应的平衡常数K=__(保留两位小数)。
(2)T℃时,以一定流速、不同物质的量的H2O(g)和COS(g)通过流化床,测得COS(g)脱除速率变化关系如图。
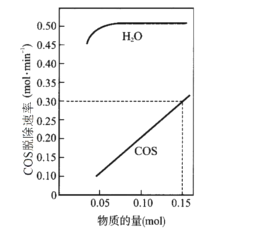
已知:COS脱除反应机理如下,其中吸附在催化剂表面的物种用*标注。
a.吸附:H2O→H2O*
b.反应:COS+H2O*→CO2+H2S*
c.脱附:H2S*→H2S
①若COS(g)脱除速率v=knx(COS)ny(H2O)(molmin-1),由图中的数据可算出x、k的值:x=__,k=__。
②“吸附”步骤为__(填“快反应”或“慢反应”),理由是__。
③脱除反应的决速步骤为__(填“a”、“b”或“c”)。
④少量氢气可以抑制催化剂积硫(S*)中毒,分析该流化床中可能存在的可逆反应是__。
(3)工业上常采用下图所示电解装置,将气态废弃物中的硫化氢转化为可利用的硫。首先通电电解K4[Fe(CN)6]与KHCO3的混合溶液,通电一段时间后,再向所得溶液通入H2S时发生反应的离子方程式为2[Fe(CN)6]3-+2CO32-+H2S═2[Fe(CN)6]4-+2HCO3-+S↓.电解过程中阴极区电极反应式为_。

【答案】-35 2.67 1 2 快反应 H2O(g)的物质的量不影响总反应速率 b S*+H2![]() H2S* 2HCO3-+2e-=H2↑+2CO32-
H2S* 2HCO3-+2e-=H2↑+2CO32-
【解析】
(1)①已知:①H2(g)+COS(g)H2S(g)+CO(g)△H1=+6.2kJmol-1
②H2(g)+CO2(g)H2O(g)+CO(g)△H2=+41.2kJmol-1
根据盖斯定律,反应①-②即可得COS精度脱除反应H2O(g)+COS(g)H2S(g)+CO2(g)△H=(6.2-41.2)kJ/mol=-35kJ/mol,故答案为:-35;
②根据题意列三段式:
H2O(g)+COS(g)=H2S(g)+CO2(g)(单位:mol)
起始量: 1 2 0 0
转化量: x x x x
平衡量:1-x 2-x x x
则![]() ,解得x=0.8,平衡常数K=
,解得x=0.8,平衡常数K=![]() =2.67,
=2.67,
故答案为:2.67;
(2)①根据图示,当H2O的物质的量固定时,COS(g)脱除速率为COS(g)物质的量的2倍,则x=1,k=2,故答案为:1;2;
②根据图示,由于H2O(g)的物质的量不影响总反应速率,因此“吸附”步骤是快反应,
故答案为:快反应;H2O(g)的物质的量不影响总反应速率;
③根据COS(g)脱除速率与COS(g)物质的量的关系可知脱除反应的决速步骤为b,
故答案为:b;
④少量氢气可以抑制催化剂积硫(S*)中毒,该过程可逆反应可能时S*+H2H2S*,
故答案为:S*+H2H2S*;
(3)根据信息可知,电解后溶液中存在CO32-,结合阴极化合价降低,电极反应式为2HCO3-+2e-=H2↑+2CO32-,
故答案为:2HCO3-+2e-=H2↑+2CO32-。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案