题目内容
【题目】锌在工业中有重要作用,也是人体必需的微量元素,回答下列问题:
(1)Zn2+原子核外电子排布式为_______________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)______I1(Cu)填“大于”或“小于”)。原因是_______________________________。
(3)ZnF2具有较高的熔点(872℃),其化学键类型是______,ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是_____________________________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为______,C原子的杂化形式为___________________。
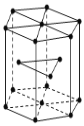
(5)金属Zn晶体中这种堆积方式称为_______________。该晶胞中含有的微粒个数为______。
【答案】1s22s22p63s23p63d10或[Ar]3d10 大于 Zn原子轨道中电子处于全满状态,Cu失去一个电子内层电子达到全充满稳定状态 离子键 ZnF2属于离子化合物,而ZnCl2、ZnBr2、ZnI2为共价化合物,ZnCl2、ZnBr2、ZnI2分子极性较小,乙醇、乙醚等有机溶剂属于分子晶体极性较小,所以互溶 平面正三角形 sp2 六方最密堆积 6
【解析】
(1)Zn原子核外有30个电子,分别分布在1s、2s、2p、3s、3p、3d、4s能级上,根据构造原理书写其离子核外电子排布式;
(2)轨道中电子处于全满、全空、半满时较稳定,失去电子需要的能量较大;
(3)离子晶体熔沸点较高,离子晶体中含有离子键;极性分子的溶质易溶于极性分子的溶剂,根据相似相溶原理分析;
(4)ZnCO3中,阴离子CO32-中C原子价层电子对个数=3+![]() =3且不含孤电子对,根据价层电子对互斥理论判断碳酸根离子空间构型及C原子的杂化形式;
=3且不含孤电子对,根据价层电子对互斥理论判断碳酸根离子空间构型及C原子的杂化形式;
(5)结合金属Zn晶胞特点确定堆积方式和均摊法计算晶胞中含有的原子数目。
(1)Zn原子核外有30个电子,分别分布在1s、2s、2p、3s、3p、3d、4s能级上,则Zn2+核外电子排布式为1s22s22p63s23p63d10或[Ar]3d10;
(2)轨道中电子处于全满、全空、半满时较稳定,失去电子需要的能量较大,Zn原子轨道中电子处于全满状态,Cu失去一个电子内层电子达到全充满稳定状态,所以Cu较Zn易失电子,则第一电离能Cu<Zn;
(3)离子晶体熔沸点较高,熔沸点较高ZnF2,为离子晶体,离子晶体中含有离子键;
根据相似相溶原理知,极性分子的溶质易溶于极性分子的溶剂,ZnF2属于离子化合物而ZnCl2、ZnBr2、ZnI2为共价化合物,ZnCl2、ZnBr2、ZnI2分子极性较小,乙醇、乙醚等有机溶剂属于分子晶体极性较小,所以互溶;
(4)ZnCO3中,阴离子CO32-中C原子价层电子对个数=3+![]() =3且不含孤电子对,根据价层电子对互斥理论判断碳酸根离子空间构型及C原子的杂化形式分别为平面正三角形;sp2杂化;
=3且不含孤电子对,根据价层电子对互斥理论判断碳酸根离子空间构型及C原子的杂化形式分别为平面正三角形;sp2杂化;
(5)金属Zn晶胞按ABABABAB···的方式堆积,为六方最密堆积;该晶胞中Zn原子个数=12×![]() +2×
+2×![]() +3=6。
+3=6。

 阅读快车系列答案
阅读快车系列答案【题目】氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
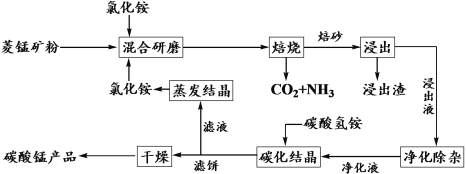
已知:①菱锰矿石主要成分是MnCO3,还含有少量Fe、Al、Ca、Mg等元素;
②相关金属离子[c(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH如下:
金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
回答下列问题:
(1)“焙烧”时主要反应的化学方程式为__________________。
(2)分析下列图1、图2、图3,氯化铵焙烧菱镁矿的最佳条件是:_________________。

(3)浸出液“净化除杂”过程如下:首先加入MnO2将Fe2+氧化为Fe3+,反应的离子方程式为________________________;然后调节溶液pH使Fe3+、Al3+沉淀完全。
(4)碳化结晶时,发生反应的离子方程式为___________,碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是___________________。
(5)流程中能循环利用的固态物质是____________。