15.下列有关物质检验的实验结论正确的是( )
| 选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| D | 取1mL20%的蔗糖溶液,加入3~5滴稀硫酸,水浴加热5min后,直接加入少量新制备的Cu(OH)2,加热3~5min,没有产生砖红色沉淀 | 说明蔗糖没有水解. |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
14.将Na2O2投入H2O中发生的反应为:2Na2O2+2H2O=4NaOH+O2↑.下列说法正确的是( )
0 172740 172748 172754 172758 172764 172766 172770 172776 172778 172784 172790 172794 172796 172800 172806 172808 172814 172818 172820 172824 172826 172830 172832 172834 172835 172836 172838 172839 172840 172842 172844 172848 172850 172854 172856 172860 172866 172868 172874 172878 172880 172884 172890 172896 172898 172904 172908 172910 172916 172920 172926 172934 203614
| A. | 反应中H2O作还原剂 | |
| B. | Na2O2 和Na2O2 均属于碱性氧化物 | |
| C. | Na2O2晶体中阴、阳离子个数之比为1:1 | |
| D. | 反应中Na2O2既发生氧化反应,又发生还原反应 |
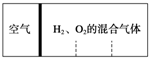 如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的$\frac{1}{4}$)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆.活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央.则原来H2、O2的体积之比可能为7:2 或4:5.
如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的$\frac{1}{4}$)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆.活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央.则原来H2、O2的体积之比可能为7:2 或4:5.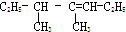 4,5-二甲基-3-庚烯
4,5-二甲基-3-庚烯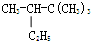 2,2,3一三甲基戊烷
2,2,3一三甲基戊烷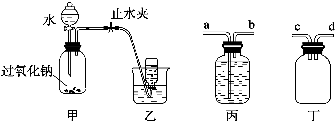
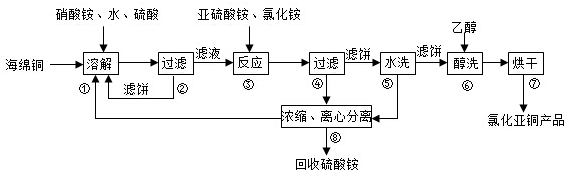
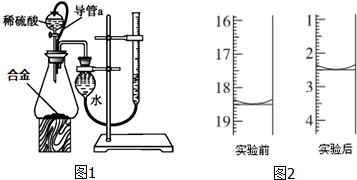 可利用以下方法测定铝镁合金(不含其它元素)组分含量
可利用以下方法测定铝镁合金(不含其它元素)组分含量