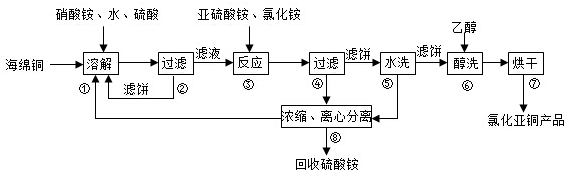
题目内容
16.某反应体系中的物质有:Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O.已知K2S2O8的氧化性比K2Cr2O7强.(1)请将以上反应物与生成物编写成一个氧化还原反应方程式(不要求配平)7H2O+Cr2(SO4)3+3K2S2O8=7H2SO4+2K2SO4+K2Cr2O7
(2)反应中,被还原的物质是K2S2O8Cr2(SO4)3是还原剂
(3)在酸性条件下K2Cr2O7与草酸(H2C2O4)反应的产物是:Cr2(SO4)3、CO2、K2SO4和H2O,则还原剂与氧化剂物质的量之比为3:1.
分析 (1)分析各种物质所含元素的化合价变化结合K2S2O8的氧化性比K2Cr2O7强依据氧化还原反应的规律推知反应物和生成物,写出方程式;
(2)氧化还原反应中所含元素化合价降低的反应为氧化剂,被还原;所含元素化合价升高的反应为还原剂,被氧化;
(3)依据物质所含元素的化合价变化判断氧化剂和还原剂,依据氧化剂得到的电子总数=还原剂失去的电子总数计算解答.
解答 解:(1)Cr2(SO4)3→K2Cr2O7铬元素化合价升高;K2S2O8→K2SO4、H2SO4硫元素化合价降低,又因为K2S2O8的氧化性比K2Cr2O7强,所以反应物为:K2S2O8和Cr2(SO4)3,生成物为K2Cr2O7、K2SO4、H2SO4,依据原子个数守恒,可知水为反应物,则反应的方程式为:
K2S2O8+Cr2(SO4)3+H2O→K2Cr2O7+K2SO4+H2SO4;
故答案为:K2S2O8+Cr2(SO4)3+H2O→K2Cr2O7+K2SO4+H2SO4;
(2)K2S2O8+Cr2(SO4)3+H2O→K2Cr2O7+K2SO4+H2SO4中K2S2O8中S化合价降低,被还原;Cr2(SO4)3中Cr元素化合价升高被氧化,做还原剂;
故答案为:K2S2O8;还原剂;
(3)在酸性条件下K2Cr2O7与草酸(H2C2O4)反应,铬元素化合价由+6→+3,K2Cr2O7做氧化剂被还原,H2C2O4中的碳元素由+3→+4化合价升高被氧化,做还原剂,设还原剂的物质的物质的量x,氧化剂物质的量为y,
则依据氧化还原反应得失电子守恒规律可得;
x×2×(4-3)=y×2×(6-3)
化简得:x:y=3:1;
故答案为:3:1.
点评 本题考查了氧化还原反应,侧重考查氧化还原方程式书写,氧化剂、还原剂判断,明确元素化合价变化是解题关键,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 该反应中维生素C作还原剂 | |
| B. | 该反应中砷元素被氧化 | |
| C. | 河虾与西红柿同食发生了氧化还原反应 | |
| D. | 河虾与其它含维生素C较多蔬菜也不宜同食 |
| A. | 硝酸钠溶液:H+、Fe3+、SO42-、CH3COOH | |
| B. | 烧碱溶液:K+、HSO3-、NO3-、NH3•H2O | |
| C. | 空气:HCl、CO2、SO2、NO | |
| D. | 氢氧化铁胶体:H+、K+、S2-、Br- |
| A. | 硬币 | B. | 聚氯乙烯塑料 | C. | 氮化硅陶瓷 | D. | 钢筋混凝土 |
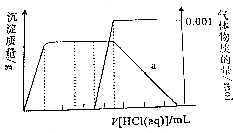 某溶液中只可能含有CO32-、AlO2-、Fe3+、Na+、SiO32-、NH3•H2O中的几种粒子,在振荡情况下,不断滴入稀盐酸,根据实验现象作出如下图象:则对该溶液的下列判断正确的是( )
某溶液中只可能含有CO32-、AlO2-、Fe3+、Na+、SiO32-、NH3•H2O中的几种粒子,在振荡情况下,不断滴入稀盐酸,根据实验现象作出如下图象:则对该溶液的下列判断正确的是( )| A. | 溶液呈碱性,一定不含Fe3+、和NH3•H2O,c(CO3 2-) 为0.001mol/L | |
| B. | 与H+反应的先后次序是:AlO2-、NH3•H2O、CO32-、HCO3-、A l(OH)3 | |
| C. | 一定含有CO32-、AlO2-、Na+、NH3•H2O,可能 含有SiO32- | |
| D. | a点溶液中存在:c(Na+)+c(H+)+3c(Al3+)=c(OH-)+c(Cl-) |
 常见金属X,有下列关系图,根据图示回答:
常见金属X,有下列关系图,根据图示回答: