题目内容
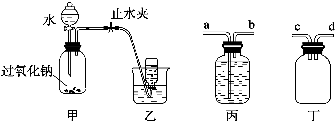
17.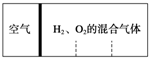 如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的$\frac{1}{4}$)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆.活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央.则原来H2、O2的体积之比可能为7:2 或4:5.
如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的$\frac{1}{4}$)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆.活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央.则原来H2、O2的体积之比可能为7:2 或4:5.
分析 反应前,左右两室的体积之比为1:3,则左右两室中气体物质的量之比为1:3,反应后,活塞处于中央,两室体积相等,则两室中气体的物质的量相等,令空气的物质的量为1mol,设H2、O2的物质的量分别为xmol、ymol,讨论氢气或氧气过量计算解答.
解答 解:令空气的物质的量为1mol,反应前,左右两室的体积之比为1:3,反应前右室的物质的量为3mol,反应后,活塞处于中央,两室体积相等,则两室中气体的物质的量相等,反应后右室气体物质的量为1mol,发生反应2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,
设H2、O2的物质的量分别为xmol、ymol,
若氢气过量,则:$\left\{\begin{array}{l}{x-2y=1}\\{x+y=3}\end{array}\right.$,解得x:y=7:2,
若氧气过量,则:$\left\{\begin{array}{l}{y-0.5x=1}\\{x+y=3}\end{array}\right.$,解得x:y=4:5,
故答案为:7:2 或4:5.
点评 本题考查混合物计算,注意左室中气体物质的量不变,根据体积变化判断右室反应前后气体物质的量,再利用赋值法与讨论法计算,难度中等.

练习册系列答案
相关题目
5.如图所示装置,肯定不符合气密性要求的是( )
| A. |  | B. |  | C. |  | D. |  |
2.区分下列各组物质的方法不正确的是( )
| A. | 水和双氧水--加二氧化锰 | |
| B. | 二氧化碳和氮气--将燃着的木条伸入瓶中 | |
| C. | 高锰酸钾和二氧化锰--看颜色 | |
| D. | 石灰水和水--通二氧化碳 |
9.若用 NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 在0.1molNaHSO4晶体中阳离子与阴离子总数为0.2NA | |
| B. | 1L0.1mol•L-1的H2SO3溶液中含有H+的数目为0.2NA | |
| C. | 7.8gNa2O2中含有的阴离子数目为0.1NA | |
| D. | 常温常压下,14g乙烯和丙烯的混合气体中氢原子数为2NA |
6.人生病时要合理用药.下列药品与其作用相匹配的是( )
| A. | 氢氧化铝:麻醉剂 | B. | 阿司匹林:消炎抗菌 | ||
| C. | 麻黄碱:止咳平喘 | D. | 青霉素:解热镇痛 |
7.下列反应的方程式正确的是( )
| A. | 2mol/L NaAlO2溶液与5mol/L 的盐酸等体积混合:2AlO2-+5H+═A l(OH)3↓+Al3++H2O | |
| B. | 表示H2SO4与NaOH反应的中和热:H2SO4+2NaOH═Na2SO4 +2H2O,△H=-57.3 kJ•mol-1 | |
| C. | 向Na2SiO3溶液中通入足量的SO2:SiO32-+SO2+H2O═H2SiO3↓+SO32- | |
| D. | 2KMnO4+HCOOK+KOH═K2MnO4 +O2 ↑+H2O |
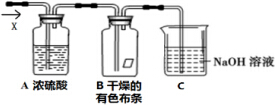 某同学应用如图所示装置研究物质的性质.其中气体X的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:
某同学应用如图所示装置研究物质的性质.其中气体X的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题: