题目内容
11.工业上,以粗铜粉(含少量CuO)为原料,采用硝酸铵氧化分解技术生产氯化亚铜(CuCl).资料:CuCl在潮湿空气中易水解氧化,难溶于醇和水,可溶于氯离子浓度较大的体系.

回答下列问题:
(1)为提高粗铜粉的溶解速率,除了适当增加反应物浓度外,还可以采取的措施是升高温度(写一条);步骤①中得到的氧化产物是CuSO4;
(2)写出步骤③中生成CuCl的离子方程式2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+;
(3)步骤④回收的副产品为(NH4)2SO4和NH4HSO4(写化学式);
(4)步骤⑤包括用pH=2的酸洗、水洗两步操作,酸洗采用的酸是硫酸(写名称);
(5)准确称取所制备的氯化亚铜样品ag,将其置于过量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用bmol/L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液cmL,反应中Cr2O72-被还原为Cr3+,样品中CuCl的质量分数为$\frac{0.597bc}{a}$×100%.
(6)CuCl(s)与O2反应生成CuCl2和一种黑色固体.在25℃、101kPa,已知该反应每消耗1molCuCl(s),放热44.4kJ,该反应的热化学方程式是4CuCl(s)+O2(g)=2CuCl2(s)+2CuO(s)△H=-177.6kJ/mol.
分析 酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的CuCl经硫酸酸洗,水洗后再用乙醇洗涤,可快速除去固体表面的水分,防止水解、氧化,步骤②、④、⑤、⑧都要进行固液分离,根据混合的水溶性进行分离,没有发生化学变化,可用离心机以及框式压滤机,以得到滤饼,氯化亚铜与氯化铁发生Fe3++CuCl═Fe2++Cu2++Cl-,加入K2Cr2O7溶液,发生6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,结合关系式解答该题.
解答 解:酸性条件下硝酸根离子具有氧化性,可氧化海绵铜(主要成分是Cu和少量CuO)生成硫酸铜,过滤后在滤液中加入亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,得到的CuCl经硫酸酸洗,水洗后再用乙醇洗涤,烘干得到氯化亚铜.
(1)升高温度可加快溶解速率,由于酸性条件下硝酸根离子具有氧化性,可氧化Cu生成CuSO4或Cu2+,则氧化产物为,故答案为:升高温度;CuSO4;
(2)铜离子与亚硫酸铵发生氧化还原反应生成CuCl,发生2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+,故答案为:2Cu2++SO32-+2Cl-+H2O=2CuCl+SO42-+2H+;
(3)反应③中铵根离子不参加反应,溶液中含硫酸根离子,则步骤④回收的副产品为(NH4)2 SO4和NH4HSO4,
故答案为:(NH4)2 SO4和NH4HSO4;
(4)由流程可知,经酸洗、水洗后得到硫酸铵,则应加入硫酸,为防止CuCl溶解,不能加入硝酸等氧化性酸,也不能加入盐酸,防止引入新杂质,
故答案为:硫酸;
(5)氯化亚铜与氯化铁发生Fe3++CuCl═Fe2++Cu2++Cl-,加入K2Cr2O7溶液,发生6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,
反应的关系式为6CuCl~6Fe2+~Cr2O72-,
6 1
n bc×10-3mol
n=6bc×10-3mol,
m(CuCl)=99.5g/mol×6bc×10-3mol=0.597bc g,
则样品中CuCl的质量分数为 $\frac{0.597bc}{a}$×100%,
故答案为:$\frac{0.597bc}{a}$×100%;
(6)该反应每消耗1molCuCl(s),放热44.4kJ,则该反应的热化学反应方程式为4CuCl(s)+O2 (g)=2CuCl2(s)+2CuO(s)△H=-177.6kJ/mol,
故答案为:4CuCl(s)+O2 (g)=2CuCl2(s)+2CuO(s)△H=-177.6kJ/mol.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握混合物分离流程中的反应、混合物分离方法及相关反应原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.

 名校课堂系列答案
名校课堂系列答案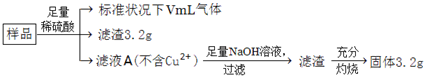
| A. | 滤液A中阳离子不可能含H+、Fe2+、Fe3+ | |
| B. | 样品中金属Fe的质量为2.24g | |
| C. | 样品中CuO的质量为4.0g | |
| D. | V=224 |
①Al ②Al2O3 ③Al(OH)3 ④Na2CO3.
| A. | ①③ | B. | ②③④ | C. | ②③ | D. | 全部 |
( )
| A. | 此时CO2的摩尔质量为88g.mol-1 | |
| B. | 标准状况下44gCO2体积约为11.2L | |
| C. | 44gCO2与28gCO含有相同数目的原子 | |
| D. | NA个O2大约为6.02×1023个 |
| A. | 4 | B. | 6 | C. | 5 | D. | 7 |
| A. | 需要称取12.5g胆矾配成500mL溶液 | |
| B. | 需要称取8.0g硫酸铜,加入500mL水 | |
| C. | 实验中用到的仪器仅有容量瓶和玻璃棒 | |
| D. | 如果选用生锈的砝码称量会导致配制的溶液浓度偏低 |
| A. | 在碱性溶液中:Na+,NO3-,S2-,SO32- | |
| B. | 使pH试纸呈红色的溶液中:Fe2+,I-,NO3-,Cl- | |
| C. | 碳酸氢钠溶液中:K+,SO42-,Cl-,H+ | |
| D. | 使酚酞试液呈红色的溶液中:Mg2+,Cu2+,SO42-,K+ |