题目内容
12.某学校课外探究小组的同学想利用过氧化钠以及如图所示的装置制取氧气,并进行相关的实验探究.取适量Na2O2粉末放人广口瓶中,在分液漏斗中加入水,逐渐滴入到广口瓶中,用排水法收集气体.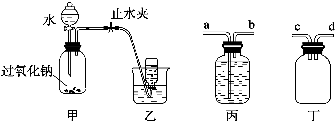
(1)写出装置甲气密性检查的方法夹紧止水夹,在分液漏斗中加入水,若漏斗中水下流速度越来越小,最后停止,说明气密性良好;
(2)写出装置甲中发生反应的化学方程式:2Na2O2+2H2O=4NaOH+O2↑.
(3)收集气体时,可能会出现倒吸现象,为了防止大量的水进入装置甲中,可以在甲、乙装置之间增加一个装置,该装置为丁(填“丙”或“丁”),c(或d)(填“a”“b”“c”或“d”)连接装置甲的出气口.
(4)某同学取上述实验广口瓶内得到的溶液,滴加在试管中,然后再滴如2~3滴酚酞试液,溶液变红,振荡试管,红色迅速褪去.
该同学通过查阅资料得知下列两个信息:
资料1:酚酞在c(OH-)为1.0×10-4mol•L-1~2.5mol•L-1时呈红色,且0.5min内不会褪色.
资料2:H2O2具有氧化性和漂白性.
该同学由此认为“红色迅速褪去”是因为溶液存在H2O2,试设计实验证明广口瓶内的溶液中含有H2O2.简述实验操作:取广口瓶中的溶液置于试管中,加入少量MnO2,若有气泡放出,用带火星的木条检验,木条复燃,则说明溶液中有H2O2.
设计实验证明H2O2溶液能够使滴有酚酞的稀NaOH溶液的红色迅速褪去:在试管中加入滴加酚酞试液的稀NaOH溶液1mL,然后再向试管中滴加1mL H2O2溶液,若“红色迅速褪去”,则证明H2O2溶液能够使滴有酚酞试液的稀NaOH溶液“红色迅速褪去”.
分析 (1)先夹紧止水夹,在分液漏斗中加入水,打开分液漏斗的活塞,根据水流速度变化判断气密性;
(2)过氧化钠与水反应生成氢氧化钠和氧气,检查写出反应的化学方程式;
(3)装置丙无法防止倒吸,应该选用装置丁;导管c、d都可以连接装置甲的出气口;
(4)双氧水不稳定,在二氧化锰作催化剂条件下能够分解生成氧气,据此可设计实验证明广口瓶内的溶液中含有H2O2;向滴有酚酞的氢氧化钠溶液中加入双氧水,若红色褪去可证明该结论.
解答 解:(1)检查装置甲气密性是否良好的方法为:夹紧止水夹,在分液漏斗中加入水,打开分液漏斗的活塞,若漏斗中水下流速度越来越小,最后停止,说明气密性良好,
故答案为:夹紧止水夹,在分液漏斗中加入水,若漏斗中水下流速度越来越小,最后停止,说明气密性良好;
(2)过氧化钠与水反应生成氢氧化钠和氧气,反应的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(3)装置丙没有防止倒吸的功能,应该选用装置丁,当发生倒吸时水进入装置丁,从而避免了大量水进入装置甲;与装置甲的出气口相连的可以是c或d,
故答案为:丁;c(或d);
(4)证明广口瓶内的溶液中含有H2O2的方法为:取广口瓶中的溶液置于试管中,加入少量MnO2,若有气泡放出,用带火星的木条检验,木条复燃,则说明溶液中有H2O2,
证明H2O2溶液能够使滴有酚酞的稀NaOH溶液的红色迅速褪去的方法为:在试管中加入滴加酚酞试液的稀NaOH溶液1 mL,然后再向试管中滴加1 mL H2O2溶液,若“红色迅速褪去”,则证明H2O2溶液能够使滴有酚酞试液的稀NaOH溶液“红色迅速褪去”,
故答案为:取广口瓶中的溶液置于试管中,加入少量MnO2,若有气泡放出,用带火星的木条检验,木条复燃,则说明溶液中有H2O2;在试管中加入滴加酚酞试液的稀NaOH溶液1 mL,然后再向试管中滴加1 mL H2O2溶液,若“红色迅速褪去”,则证明H2O2溶液能够使滴有酚酞试液的稀NaOH溶液“红色迅速褪去”.
点评 本题考查了性质实验方案的设计与评价,题目难度中等,明确实验目的及实验原理为解答关键,注意掌握过氧化钠与水反应的实质、性质实验方案设计的原则,试题培养了学生的分析能力及化学实验能力.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案| A. | Na+、K+、AlO2-、Cl- | B. | Ba2+、Na+、Al3+、SO42- | ||
| C. | K+、Mg2+、Cl-、NO3- | D. | Na+、Ca2+、Cl-、HCO3- |
| A. | 所用NaOH已经潮解 | |
| B. | 向容量瓶中加水定容时俯视标线 | |
| C. | 用量筒量取所需的浓盐酸时俯视刻度线 | |
| D. | 定容后倒转容量瓶几次,发现液面最低点低于标线,再补几滴水 |
| A. | NO2 | B. | N2 | C. | NH3 | D. | SO2 |
| A. | 常温常压下,28g CO和N2的混合气体中含有的分子总数为NA | |
| B. | 1 mol铁与足量盐酸完全反应时失去的电子数为3NA | |
| C. | 78g过氧化钠晶体中,含2NA个阴离子 | |
| D. | 标准状况下,22.4 LH2S和SO2的混合气体中含有的分子总数为NA |
| A. | 将少量金属钠放入冷水中:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 将铝片加入盐酸溶液中:2Al+6H+=2Al3++3H2↑ | |
| C. | 向碳酸钠溶液中加入CH3COOH:CO${\;}_{3}^{2-}$+2H+=CO2↑+H2O | |
| D. | 向澄清石灰水中通入过量的二氧化碳:Ca2++2OH-=CaCO3↓+H2O |
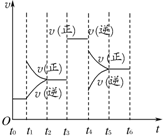 在一密闭容器中发生下列反应:2SO2(g)+O2(g)?2SO3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系.回答下列问题:
在一密闭容器中发生下列反应:2SO2(g)+O2(g)?2SO3(g)△H<0,如图所示是某一时间段中反应速率与反应进程的曲线关系.回答下列问题: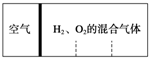 如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的$\frac{1}{4}$)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆.活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央.则原来H2、O2的体积之比可能为7:2 或4:5.
如图所示,分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的$\frac{1}{4}$)、H2和O2的混合气体,在标准状况下,若将H2、O2的混合气体点燃引爆.活塞先左弹,恢复原温度后,活塞右滑停留于容器的中央.则原来H2、O2的体积之比可能为7:2 或4:5.