题目内容
10.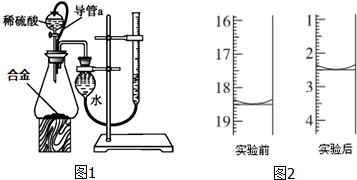 可利用以下方法测定铝镁合金(不含其它元素)组分含量
可利用以下方法测定铝镁合金(不含其它元素)组分含量【实验方案一】实验方案:铝镁合金$\stackrel{稀硫酸}{→}$测定生成气体的体积.
(1)利用如图1装置反应.
①装置中导管a的作用是使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下.
②测量收集到的气体的体积时必须包括的几个步骤:
a、调整量气管高度,使其液面高度与水准管液面高度相平;
b、使装置内的气体冷却至室温;
c、读取量气管中气体的体积.
这三步操作的正确顺序是bac(请填写步骤代号).
③实验前后碱式滴定管中液面读数分别如图2.则产生氢气的体积为16.00mL.
【实验方案二】实验方案:铝镁合金$\stackrel{NaOH溶液}{→}$测定剩余固体质量.
(2)问题讨论:①实验中发生反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
②若实验中称取4.05g 铝镁合金粉末样品,投入VmL、质量分数为5%的 NaOH溶液中(ρ=1g/cm3),充分反应.则NaOH溶液的体积V≥120mL.
③实验中当铝镁合金充分反应后,过滤、干燥(干燥时不发生化学变化)并称量固体质量,你认为这样测出的铝的质量分数偏小(填“准确”“偏大”或“偏小”),如果不准确,应该补充的操作是洗涤沉淀(若测量结果准确,此空不填).
【实验方案三】:称量一定质量铝镁合金粉末,通纯氧使其充分灼烧.
(3)若铝镁合金粉末为x g,完全反应后测得固体质量为yg,则原铝镁合金粉末中镁的质量分数为$\frac{17x-9y}{2x}$(用含x、y代数式表示).
分析 【实验方案一】镁和铝与酸反应生成的氢气,反应的离子方程式为:Mg+2H+=Mg2++H2↑,2Al+6H+=2AL3++3H2↑;
(1)①装置中导管a可以平衡内外压强,使液体顺利滴下;
②要准确测量气体体积必须保持量筒内外气体的温度和压强相等,因此在读取量筒内气体的体积之前,应使试管和量筒内的气体都冷却至室温;再调节量筒内外液面高度使之相同;
③滴定管的数值零刻度在上方,两次的体积之差为测定的氢气的体积(注意应保持干燥管与滴定管内液面等高);
【实验方案二】实验方案:铝与氢氧化钠溶液反应生成的氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+H2↑;
(2)①铝与氢氧化钠溶液反应生成偏铝酸钠与氢气;
②根据c=$\frac{1000ρω}{M}$计算氢氧化钠溶液的物质的量浓度,镁的质量分数最小时,金属铝的质量最大,需要的氢氧化钠溶液最多,实际需要氢氧化钠溶液的体积应大于或等于最大值,据此计算;
③合金与碱反应,剩余固体的质量为镁的质量,未进行洗涤沉淀,镁的质量偏大,铝的质量分数偏小;补充的操作是洗涤沉淀;
【实验方案三】:
(3)设出金属镁和铝的物质的量,根据合金的质量和灼烧后的质量列式计算出镁的物质的量,再计算出镁的质量分数.
解答 解:【实验方案一】镁和铝与酸反应生成的氢气,反应的离子方程式为:Mg+2H+=Mg2++H2↑,2Al+6H+=2AL3++3H2↑;
(1)①分液漏斗上部和锥形瓶气压相通,可以保证恒压滴液漏斗中的液体顺利滴下,打开分液漏斗活塞时稀硫酸能顺利滴下,
故答案为:使分液漏斗内气体压强与锥形瓶内气体压强相等,打开分液漏斗活塞时稀硫酸能顺利滴下;
②因为排出的气体是需要用排出的水的体积衡量的,而反应前后的量筒温度是不同的,因此,反应终止应该先停止加热,待体系恢复到室温时,才取出导管.这一步操作跟通常的实验不同,所以停止加热时导管的出口要高于量筒内的液面,此时即使不取出导管而停止加热,也不会造成水的倒吸;停止加热、回到室温后,将量筒下移以调节量筒内的液面与水槽一致,此时量筒内气体压强也为大气压,读数才是正确的;所以正确的操作顺序为:b、使装置内的气体冷却至室温;a、调整量气管高度,使其液面高度与水准管液面高度相平,c、读取量气管中气体的体积,
故答案为:bac;
③滴定管的数值零刻度在上方,两次的体积之差为测定的氢气的体积,收集氢气后滴定管内液面读数减小,反应前滴定管读数为18.50mL,反应后滴定管读数为2.50mL,所以测定氢气的体积为:18.50mL-2.50mL=16.00mL,
故答案为:16.00;
【实验方案二】实验方案:铝与氢氧化钠溶液反应生成的氢气,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+H2↑;
(2)①铝与氢氧化钠溶液反应生成偏铝酸钠与氢气,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
②质量分数为5%的 NaOH溶液中(ρ=1g/cm3),c=$\frac{1000ρω}{M}$=$\frac{1000×1g/c{m}^{3}×5%}{40g/mol}$=1.25mol/L,
含镁为零时,金属铝的含量最高,4.05g 合金中铝的质量为4.05g,则:
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54g 2mol
4.05g n
所以54g:4.05g=2mol:n解得:n=0.15mol,V=$\frac{n}{c}$=$\frac{0.15mol}{1.25mol/L}$=120mL,
故V(NaOH溶液)≥120mL;
故答案为:120;
③铝和碱反应,镁和碱不反应,若未洗涤过滤所得的不溶物镁,镁的质量偏大,铝的质量分数偏小,补充的操作是洗涤沉淀,
故答案为:偏小;洗涤沉淀;
【实验方案三】:
(3)设xg铝镁合金粉末中含有n mol镁、zmol铝,则24n+27z=x①,
再根据反应关系式:Mg~MgO、Al~Al2O3,最后得到了yg氧化物,据此列式为:40n+51z=y②,
根据①②解得:z=$\frac{3y-5x}{18}$mol,铝的质量为:27g/mol×$\frac{3y-5x}{18}$mol=$\frac{9y-15x}{2}$g,合金中镁的质量分数为:$\frac{x-\frac{9y-15x}{2}}{x}$=$\frac{17x-9y}{2x}$,
故答案为:$\frac{17x-9y}{2x}$.
点评 本题考查物质含量的测定、对实验原理与装置的理解、实验方案设计等,难度中等,理解实验原理是解题的关键,是对知识的综合考查,要求学生具有扎实的基础及综合运用知识分析问题、解决问题的能力.

 阅读快车系列答案
阅读快车系列答案| A. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 反应H2(g)+I2(g)?2HI(g) 达到平衡后,压缩容器的体积,体系颜色加深 | |
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 | |
| D. | 增大压强,有利于SO2与O2反应生成SO3 |
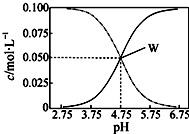 25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )
25℃,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组醋酸和醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示.有关离子浓度关系分析正确的是( )| A. | pH=5.5溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | W点表示溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(CH3COOH) | |
| C. | pH=3.5溶液中:c(Na+)-c(OH-)+c(CH3COOH)=0.1 mol/L | |
| D. | 向W点所表示溶液中通入0.05molHCl气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-) |
| A. | 氢氧化铁 | B. | 金属铝 | C. | 氧化铝 | D. | 硫酸铜 |
| A. |  | B. |  | C. |  | D. |  |
| 选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| D | 取1mL20%的蔗糖溶液,加入3~5滴稀硫酸,水浴加热5min后,直接加入少量新制备的Cu(OH)2,加热3~5min,没有产生砖红色沉淀 | 说明蔗糖没有水解. |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
| A. | 水和双氧水--加二氧化锰 | |
| B. | 二氧化碳和氮气--将燃着的木条伸入瓶中 | |
| C. | 高锰酸钾和二氧化锰--看颜色 | |
| D. | 石灰水和水--通二氧化碳 |
| A. | 氢氧化铝和碳酸氢钠都可以作为治疗胃酸过多的药剂 | |
| B. | 血液透析是利用了胶体的性质 | |
| C. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| D. | 碘是人体必需微量元素,所以要多吃富含碘单质的食物 |