题目内容
14.将Na2O2投入H2O中发生的反应为:2Na2O2+2H2O=4NaOH+O2↑.下列说法正确的是( )| A. | 反应中H2O作还原剂 | |
| B. | Na2O2 和Na2O2 均属于碱性氧化物 | |
| C. | Na2O2晶体中阴、阳离子个数之比为1:1 | |
| D. | 反应中Na2O2既发生氧化反应,又发生还原反应 |
分析 反应2Na2O2+2H2O═4NaOH+O2↑中,只有O元素化合价发生变化,Na2O2既是氧化剂又是还原剂,以此解答.
解答 解:该反应过氧化钠中O元素化合价由-1价变为-2价和0价,所以过氧化钠是氧化剂、还原剂,
A.该反应中过氧化钠是氧化剂、还原剂,水既不是氧化剂又不是还原剂,故A错误;
B.过氧化钠的是过氧化物,不是碱性氧化物,故B错误;
C.Na2O2晶体中阳离子为Na+、阴离子为O22-,所以Na2O2晶体中阴阳离子个数之比为1:2,故C错误;
D.过氧化钠是氧化剂、还原剂,所以反应中Na2O2既发生氧化反应,又发生还原反应,故D正确;
故选D.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.下列说法正确的是( )
| A. | NH3的摩尔质量为17g | |
| B. | 48gO3含有的臭氧分子数为6.02×1023 | |
| C. | 1mol•L-1NaCl溶液中含1molNa+ | |
| D. | 标准状况下,1molH2O的体积为22.4 L |
2.按原子序数递增的顺序(稀有气体除外),对第三周期元素性质的描述正确的是( )
| A. | 原子半径和离子半径均减小 | |
| B. | 氧化物对应的水化物碱性减弱,酸性增强 | |
| C. | 非金属气态氢化物稳定性逐渐增强 | |
| D. | 单质的熔点降低 |
6.下表各组物质中,物质之间不可能实现如X$\stackrel{M}{→}$Y$\stackrel{M}{→}$Z所示转化的是( )
| 选项 | X | Y | Z | M |
| A | Fe(s) | FeCl2 | FeCl3 | Cl2 |
| B | NaOH(aq) | Na2CO3 | NaHCO3 | CO2 |
| C | NH3(g) | NO | NO2 | O2 |
| D | S(s) | SO2 | SO3 | O2 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
3.将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变则下列说法正确的是( )
| A. | 反应过程只有O2生成,共6.72 L的气体(标况) | |
| B. | 本过程一共涉及了三个化学反应 | |
| C. | 最终得到氢氧化铝的沉淀 | |
| D. | 最终得到的溶液中c(NaCl)=0.15 mol•L-1 |
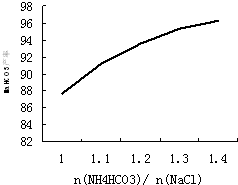 碳酸氢铵是一种重要的铵盐.实验室中,将二氧化碳通入氨水可制得碳酸氢铵.在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵.完成下列填空:
碳酸氢铵是一种重要的铵盐.实验室中,将二氧化碳通入氨水可制得碳酸氢铵.在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵.完成下列填空: