5. 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
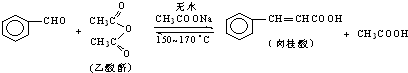
药品物理常数
填空:
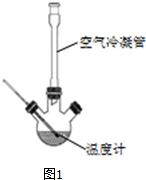
Ⅰ、合成:反应装置如图1所示.向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀.在150~170℃加热1小时,保持微沸状态.
(1)空气冷凝管的作用是使反应物冷凝回流.
(2)该装置的加热方法是空气浴(或油浴).加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是乙酸酐蒸出,反应物减少,平衡左移.
(3)不能用醋酸钠晶体(CH3COONa•3H2O)的原因是乙酸酐遇热水水解.
Ⅱ、粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:

(4)加饱和Na2CO3溶液除了转化醋酸,主要目的是将肉桂酸转化为肉桂酸钠,溶解于水.
(5)操作I是冷却结晶;若所得肉桂酸晶体中仍然有杂质,欲提高纯度可以进行的操作是重结晶(均填操作名称).
(6)设计实验方案检验产品中是否含有苯甲醛取样,加入银氨溶液共热,若有银镜出现,说明含有苯甲醛,或加入用新制氢氧化铜悬浊液,若出现砖红色沉淀,说明含有苯甲醛.
(7)若最后得到纯净的肉桂酸5.0g,则该反应中的产率是75%(保留两位有效数字)
 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
药品物理常数
| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
| 沸点(℃) | 179.6 | 138.6 | 300 | 118 |
| 相对分子质量 | 106 | 102 | 148 | 60 |
Ⅰ、合成:反应装置如图1所示.向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀.在150~170℃加热1小时,保持微沸状态.
(1)空气冷凝管的作用是使反应物冷凝回流.
(2)该装置的加热方法是空气浴(或油浴).加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是乙酸酐蒸出,反应物减少,平衡左移.
(3)不能用醋酸钠晶体(CH3COONa•3H2O)的原因是乙酸酐遇热水水解.
Ⅱ、粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:

(4)加饱和Na2CO3溶液除了转化醋酸,主要目的是将肉桂酸转化为肉桂酸钠,溶解于水.
(5)操作I是冷却结晶;若所得肉桂酸晶体中仍然有杂质,欲提高纯度可以进行的操作是重结晶(均填操作名称).
(6)设计实验方案检验产品中是否含有苯甲醛取样,加入银氨溶液共热,若有银镜出现,说明含有苯甲醛,或加入用新制氢氧化铜悬浊液,若出现砖红色沉淀,说明含有苯甲醛.
(7)若最后得到纯净的肉桂酸5.0g,则该反应中的产率是75%(保留两位有效数字)
4.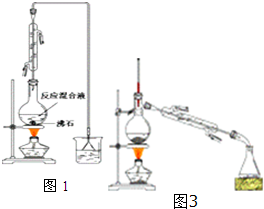 已知:
已知:
根据题意完成填空:
(一)制备1-溴丁烷粗产品:在图1装置的圆底烧瓶中依次加入NaBr,10mL正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30min.化学方程式:NaBr+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O
(1)反应装置中加入沸石的目的是防止液体暴沸.配制体积比为1:1的硫酸所用的定量仪器为b(选填编号)
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)冷凝管的进水方向为下进上出,这样选择的原因是能更充分冷凝.
(3)图2装置中,能代替上图中最后收集装置的是ABD(填序号).

(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是d(选填编号).
a.蒸馏 b.氢氧化钠溶液洗涤 c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
(二)制备精品:将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按图3装置蒸馏.(5)收集产品时,控制的温度应在101.6℃左右;
(6)实验制得的1-溴丁烷的质量为10.895g,则正丁醇的产率为72.7%.
 已知:
已知:| 药品名称 | 熔点/℃ | 沸点(℃) | 密度g/cm3 | 溶解性 |
| 丁醇 | -89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |
(一)制备1-溴丁烷粗产品:在图1装置的圆底烧瓶中依次加入NaBr,10mL正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30min.化学方程式:NaBr+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O
(1)反应装置中加入沸石的目的是防止液体暴沸.配制体积比为1:1的硫酸所用的定量仪器为b(选填编号)
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)冷凝管的进水方向为下进上出,这样选择的原因是能更充分冷凝.
(3)图2装置中,能代替上图中最后收集装置的是ABD(填序号).

(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是d(选填编号).
a.蒸馏 b.氢氧化钠溶液洗涤 c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
(二)制备精品:将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按图3装置蒸馏.(5)收集产品时,控制的温度应在101.6℃左右;
(6)实验制得的1-溴丁烷的质量为10.895g,则正丁醇的产率为72.7%.
2.在某温度下,工业合成氨反应N2+3H2 $?_{催化剂}^{高温、高压}$2NH3(正反应放热),把氮气和氢气以1:1的物质的量之比混匀后分成两等份,同时分别充入A体积和B体积两个装有催化剂的真空容器中(A、B两容器的容积固定),在保持相同温度的条件下,A、B两个容器的合成氨反应先后达到平衡状态.请回答:
(1)写出该反应的平衡常数表达式$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]×[{H}_{2}]^{3}}$,KA等于KB(选填“大于”、“小于”或“等于”).
(2)欲增大该反应K值,可以采取的措施为B
A 升高温度 B 降低温度 C 增大N2、H2的浓度 D 使用高效的催化剂
(3)分析以下表中数据后,完成下列问题[M(平)表示平衡时混合物的平均相对分子质量]
达平衡时,容器A中N2的转化率为10%,容器B中M(平)为18.75,容器A(选填“A”或“B”)体积更大.
(4)常温下将氨气溶于水配成0.1mol/L的氨水100mL,此时溶液中$\frac{[{H}^{+}]}{[O{H}^{-}]}$=10-8,则溶液中NH3•H2O的电离程度用电离度表示为1%,水电离出的c(OH-)=10-11mol/L,再向溶液中加水稀释到1L,所得溶液中$\frac{[{H}^{+}]}{[O{H}^{-}]}$增大(填“增大、不变、减小或不确定”)
(5)已知三种酸的电离平衡常数如下表,浓度均为0.1mol/L的NaCN溶液、Na2CO3溶液、NaHCO3溶液和CH3COONa溶液的pH值分别为a、b、c、d,则a、b、c、d按从大到小的顺序排列为b>a>c>d,写出向NaCN溶液中通入少量CO2气体的离子方程式为CN-+CO2+H2O=HCN+HCO3-.
(1)写出该反应的平衡常数表达式$\frac{[N{H}_{3}]^{2}}{[{N}_{2}]×[{H}_{2}]^{3}}$,KA等于KB(选填“大于”、“小于”或“等于”).
(2)欲增大该反应K值,可以采取的措施为B
A 升高温度 B 降低温度 C 增大N2、H2的浓度 D 使用高效的催化剂
(3)分析以下表中数据后,完成下列问题[M(平)表示平衡时混合物的平均相对分子质量]
| 容器A | 容器B | |
| M(平) | 16.7 | |
| 平衡时N2的转化率 | 20% |
(4)常温下将氨气溶于水配成0.1mol/L的氨水100mL,此时溶液中$\frac{[{H}^{+}]}{[O{H}^{-}]}$=10-8,则溶液中NH3•H2O的电离程度用电离度表示为1%,水电离出的c(OH-)=10-11mol/L,再向溶液中加水稀释到1L,所得溶液中$\frac{[{H}^{+}]}{[O{H}^{-}]}$增大(填“增大、不变、减小或不确定”)
(5)已知三种酸的电离平衡常数如下表,浓度均为0.1mol/L的NaCN溶液、Na2CO3溶液、NaHCO3溶液和CH3COONa溶液的pH值分别为a、b、c、d,则a、b、c、d按从大到小的顺序排列为b>a>c>d,写出向NaCN溶液中通入少量CO2气体的离子方程式为CN-+CO2+H2O=HCN+HCO3-.
| 化学式 | 电离常数(298K) |
| 氢氰酸 | K=4.5×10-10 |
| 碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
| 醋酸 | K=1.75×10-5 |
11.材料与人类生活密切相关.下列物品与对应的材料相匹配的是( )
| A. | 光导纤维--硅酸盐材料 | B. | 透明饮料瓶--合金材料 | ||
| C. | 纯棉织物--合成纤维材料 | D. | 橡胶轮胎--有机高分子材料 |
10.将浓硝酸分解的气体收集在一支试管中,再将试管倒插在水中,可能出现的现象是试管内液面上升,原因是:NO2和O2的混合气体溶于水使试管内压强减小,化学方程式为4NO2+O2+2H2O=4HNO3 .
0 172638 172646 172652 172656 172662 172664 172668 172674 172676 172682 172688 172692 172694 172698 172704 172706 172712 172716 172718 172722 172724 172728 172730 172732 172733 172734 172736 172737 172738 172740 172742 172746 172748 172752 172754 172758 172764 172766 172772 172776 172778 172782 172788 172794 172796 172802 172806 172808 172814 172818 172824 172832 203614

 2C(g)+B(g)△H=+150akJ/mol.
2C(g)+B(g)△H=+150akJ/mol.