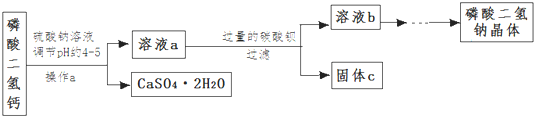
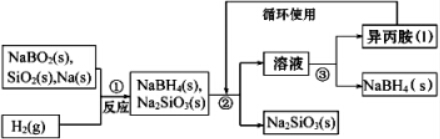
题目内容
9.设NA为阿伏加德罗常数的值.下列说法正确的有( )①标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA
②常温常压下,等物质的量的N2与CO气体含有的原子数目均为NA
③标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA
④常温常压下,Na2O2与足量H2O反应,生成0.2mol O2转移电子的数目为0.4NA
⑤将含0.1mol FeCl3的饱和溶液制成胶体后,生成的Fe(OH)3胶粒数目为0.1NA
⑥1mol FeI2交于足量氯气反应时转移的电子数为2NA.
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
分析 ①氯气与水的反应是可逆反应;
②N2与CO均是双原子分子,根据分子组成计算原子数;
③6.72 L NO2即0.3mol二氧化氮与水反应生成0.2mol硝酸和0.1mol一氧化氮;
④Na2O2与H2O的反应2Na2O2+2H2O=4NaOH+O2↑,此反应转移2mol电子,生成1molO2;
⑤1个Fe(OH)3胶粒是多个Fe(OH)3分子的聚集体;
⑥亚铁离子和碘离子都能够被氯气氧化,1mol碘化亚铁完全反应消耗1.5mol氯气.
解答 解:①氯气与水的反应是可逆反应,故0.1molCl2溶于水,转移的电子数目小于0.1NA,故错误;
②N2与CO均是双原子分子,常温常压下,等物质的量的N2与CO气体含有的原子数目相等,但是物质的量不知道,无法计算其数目,故错误;
③标况下,6.72L二氧化氮的物质的量为0.3mol,0.3mol二氧化氮与水反应生成了0.1mol一氧化氮,转移了0.2mol电子,转移的电子数目为0.2NA,故错误;
④Na2O2与H2O的反应:2Na2O2+2H2O=4NaOH+O2↑此反应转移2mol电子,生成1molO2,故当生成0.2molO2,转移电子0.4mol,数目为0.4NA,故正确;
⑤1个Fe(OH)3胶粒是多个Fe(OH)3分子的聚集体,故0.1mol FeCl3的饱和溶液制成胶体后,Fe(OH)3胶粒的个数小于0.1NA个,故错误;
⑥1molFeI2中含有1mol亚铁离子、2mol碘离子,完全反应需要消耗1.5mol氯气,转移了3mol电子,转移的电子数为3NA,故错误.
故选A.
点评 本题考查阿伏伽德罗常数的有关计算和判断,题目难度中等,注意苯分子的碳碳键为一种独特的化学键,阿伏伽德罗常数是高考的“热点”,它既考查了学生对物质的量、粒子数、质量、体积等与阿伏伽德罗常数关系的理解,又可以涵盖多角度的化学知识内容.

 阅读快车系列答案
阅读快车系列答案| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.180 | 0.110 | 0.080 | 0.074 | 0.146 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
| A. | 离子半径大小:Y2->M2->R3+ | |
| B. | Z与M组成的化合物是形成酸雨的原因之一 | |
| C. | 将YM2通入BaCl2溶液中有大量白色沉淀产生 | |
| D. | X、Y、R的最高价氧化物的水化物两两之间能发生反应 |
| A. | 碘的升华 | B. | 生石灰溶于水 | C. | 镁与稀盐酸反应 | D. | 氨气分解 |
| A. | 4:5 | B. | 1:1 | C. | 1:5 | D. | 4:1 |
| A. | 通入HCl气体 | B. | 加入适量氢氧化钠固体 | ||
| C. | 加入适量KHCO3 | D. | 加入适量Na2CO3晶体 |
| A. | 等物质的量的氯气和液氯中含有的分子数 | |
| B. | 等质量的红磷和白磷中含有的原子数 | |
| C. | 同温、同体积的CO和NO的质子数 | |
| D. | 等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数 |