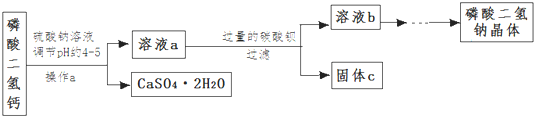
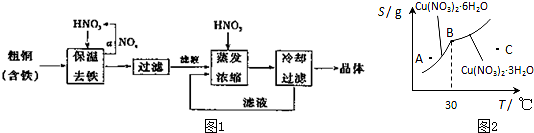
题目内容
5. 肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.
肉桂酸是香料、化妆品、医药、塑料和感光树脂等的重要原料.实验室用下列反应制取肉桂酸.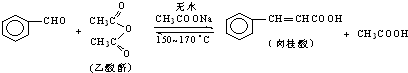
药品物理常数
| 苯甲醛 | 乙酸酐 | 肉桂酸 | 乙酸 | |
| 溶解度(25℃,g/100g水) | 0.3 | 遇热水水解 | 0.04 | 互溶 |
| 沸点(℃) | 179.6 | 138.6 | 300 | 118 |
| 相对分子质量 | 106 | 102 | 148 | 60 |
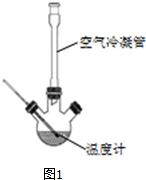
Ⅰ、合成:反应装置如图1所示.向三颈烧瓶中先后加入研细的无水醋酸钠、4.8g苯甲醛和5.6g乙酸酐,振荡使之混合均匀.在150~170℃加热1小时,保持微沸状态.
(1)空气冷凝管的作用是使反应物冷凝回流.
(2)该装置的加热方法是空气浴(或油浴).加热回流要控制反应呈微沸状态,如果剧烈沸腾,会导致肉桂酸产率降低,可能的原因是乙酸酐蒸出,反应物减少,平衡左移.
(3)不能用醋酸钠晶体(CH3COONa•3H2O)的原因是乙酸酐遇热水水解.
Ⅱ、粗品精制:将上述反应后得到的混合物趁热倒入圆底烧瓶中,进行下列操作:

(4)加饱和Na2CO3溶液除了转化醋酸,主要目的是将肉桂酸转化为肉桂酸钠,溶解于水.
(5)操作I是冷却结晶;若所得肉桂酸晶体中仍然有杂质,欲提高纯度可以进行的操作是重结晶(均填操作名称).
(6)设计实验方案检验产品中是否含有苯甲醛取样,加入银氨溶液共热,若有银镜出现,说明含有苯甲醛,或加入用新制氢氧化铜悬浊液,若出现砖红色沉淀,说明含有苯甲醛.
(7)若最后得到纯净的肉桂酸5.0g,则该反应中的产率是75%(保留两位有效数字)
分析 (1)该反应在150~170℃的条件下进行,根据表中各物质的沸点可知,反应物在这个条件下易挥发;
(2)由于该反应的条件为150~170℃,可以用空气浴(或油浴)控制,在150~170℃时乙酸酐易挥发;
(3)乙酸酐遇水易水解,所以反应中不能有水;
(4)肉桂酸难溶于水,肉桂酸钠易溶于水;
(5)要使肉桂酸从溶液中充分析出,要冷却结晶,提高纯度可以进行重结晶;
(6)检验产品中是否含有苯甲醛,通过银氨溶液或新制氢氧化铜悬浊液检验醛基的存在即可;
(7)4.8g苯甲醛的物质的量为0.0453mol,5.6g乙酸酐的物质的量为0.0549mol,根据题中反应的方程式可知,乙酸酐过量,所以理论上生成肉桂酸的质量为0.0453mol×148g/mol=6.70g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)该反应在150~170℃的条件下进行,根据表中各物质的沸点可知,反应物在这个条件下易挥发,所以空气冷凝管的作用是使反应物冷凝回流,使反应物充分反应,
故答案为:使反应物冷凝回流;
(2)由于该反应的条件为150~170℃,可以用空气浴(或油浴)控制,在150~170℃时乙酸酐易挥发,如果剧烈沸腾,乙酸酐蒸出,反应物减少,平衡左移,导致肉桂酸产率降低,
故答案为:空气浴(或油浴);乙酸酐蒸出,反应物减少,平衡左移;
(3)乙酸酐遇热水易水解,所以反应中不能有水,醋酸钠晶体(CH3COONa•3H2O)参加反应会有水,使乙酸酐水解,故答案为:乙酸酐遇热水水解;
(4)肉桂酸难溶于水,肉桂酸钠易溶于水,加饱和Na2CO3溶液将肉桂酸转化为肉桂酸钠,溶解于水,便于物质提纯,
故答案为:将肉桂酸转化为肉桂酸钠,溶解于水;
(5)要使肉桂酸从溶液中充分析出,要冷却结晶,故操作Ⅰ为冷却结晶,提高纯度可以进行重结晶,故答案为:冷却结晶;重结晶;
(6)苯甲醛中有醛基,检验产品中是否含有苯甲醛的操作为取样,加入银氨溶液共热,若有银镜出现,说明含有苯甲醛,或加入用新制氢氧化铜悬浊液,若出现砖红色沉淀,说明含有苯甲醛,
故答案为:取样,加入银氨溶液共热,若有银镜出现,说明含有苯甲醛,或加入用新制氢氧化铜悬浊液,若出现砖红色沉淀,说明含有苯甲醛;
(7)4.8g苯甲醛的物质的量为0.0453mol,5.6g乙酸酐的物质的量为0.0549mol,根据题中反应的方程式可知,乙酸酐过量,所以理论上生成肉桂酸的质量为0.0453mol×148g/mol=6.70g,所以产率=$\frac{实际产量}{理论产量}$×100%=$\frac{5.0}{6.70}$×100%=75%,
故答案为:75%.
点评 本题考查了物质制备实验的过程分析判断,反应实质和反应条件的分析判断是解题关键,题目难度中等.

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案| A. | 通入HCl气体 | B. | 加入适量氢氧化钠固体 | ||
| C. | 加入适量KHCO3 | D. | 加入适量Na2CO3晶体 |
| A. | 光导纤维--硅酸盐材料 | B. | 透明饮料瓶--合金材料 | ||
| C. | 纯棉织物--合成纤维材料 | D. | 橡胶轮胎--有机高分子材料 |
 ,G的化学式是NaAlO2.
,G的化学式是NaAlO2.