题目内容
4.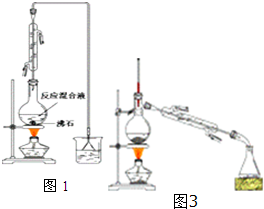 已知:
已知:| 药品名称 | 熔点/℃ | 沸点(℃) | 密度g/cm3 | 溶解性 |
| 丁醇 | -89.5 | 117.7 | 0.8098 | 微溶于水、溶于浓硫酸 |
| 1-溴丁烷 | -112.4 | 101.6 | 1.2760 | 不溶于水和浓硫酸 |
(一)制备1-溴丁烷粗产品:在图1装置的圆底烧瓶中依次加入NaBr,10mL正丁醇,2粒沸石,分批加入1:1的硫酸溶液,摇匀,加热30min.化学方程式:NaBr+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O
(1)反应装置中加入沸石的目的是防止液体暴沸.配制体积比为1:1的硫酸所用的定量仪器为b(选填编号)
a.天平 b.量筒 c.容量瓶 d.滴定管
(2)冷凝管的进水方向为下进上出,这样选择的原因是能更充分冷凝.
(3)图2装置中,能代替上图中最后收集装置的是ABD(填序号).

(4)若用浓硫酸进行实验,有机层中会呈现棕黄色,除去其中杂质的正确方法是d(选填编号).
a.蒸馏 b.氢氧化钠溶液洗涤 c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
(二)制备精品:将得到的粗1-溴丁烷依次用浓硫酸、水、10% 碳酸钠、水洗涤后加入无水氯化钙进行干燥,然后再将1-溴丁烷按图3装置蒸馏.(5)收集产品时,控制的温度应在101.6℃左右;
(6)实验制得的1-溴丁烷的质量为10.895g,则正丁醇的产率为72.7%.
分析 (1)反应装置中加入的固体M是沸石,目的是防止暴沸;用量筒量取相同量的硫酸和水再烧杯中进行混合;
(2)冷凝管是下管进水,上管出水,有利于冷却;
(3)根据图1中最后的收集装置是防倒吸装置来解答;
(4)若用浓硫酸进行实验,由于浓硫酸具有强氧化性会使部分溴离子氧化为溴单质;
a.蒸馏也会使部分原料物挥发出来;
b.氢氧化钠溶液洗涤,会使卤代烃发生水解,主成分减少;
c.用四氯化碳无法萃取,由于溴和卤代烃都能溶于四氯化碳;
d.用亚硫酸钠溶液洗涤可和溴发生氧化还原反应,再通过分液操作即可分离;
(5)根据表中1-溴丁烷的沸点可知收集产品时,控制的温度应在101.6℃左右;
(6)原料正丁醇的质量为lOmL×0.8098g/cm3=8.098g,根据题中方程式NaBr+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O,可以计算理论产生1-溴丁烷的质量为$\frac{137}{74}×8.098g$=14.99g,根据产率=$\frac{实际产量}{理论产量}$×100%计算.
解答 解:(1)反应装置中加入沸石的目的是防止暴沸;用量筒量取相同量的硫酸和水进行混合,故定量仪器为量筒;
故答案为:防止液体暴沸;b;
(2)冷凝管是下管进水,上管出水,这样冷却充分,冷凝效果好;
故答案为:下进上出; 能更充分冷凝;
(3)图1中最后的收集装置是防倒吸装置,ABD装置也可用于防倒吸;
故答案为:ABD;
(4)若用浓硫酸进行实验,由于浓硫酸具有强氧化性会使部分溴离子氧化为溴单质;
a.蒸馏也会使部分原料物挥发出来,无法除去其中杂质,故a错误;
b.氢氧化钠溶液洗涤,会使卤代烃发生水解,造成损失,故b错误;
c.由于溴和卤代烃都能溶于四氯化碳,用四氯化碳无法萃取,故c错误;
d.用亚硫酸钠溶液洗涤可和溴发生氧化还原反应,再通过分液操作即可分离,故d正确;
故答案为:d;
(5)根据表中1-溴丁烷的沸点可知收集产品时,控制的温度应在101.6℃左右;
故答案为:101.6;
(6)原料正丁醇的质量为lOmL×0.8098g/cm3=8.098g,根据题中方程式NaBr+H2SO4+CH3CH2CH2CH2OH→CH3CH2CH2CH2Br+NaHSO4+H2O,可以计算理论产生1-溴丁烷的质量为$\frac{137}{74}×8.098g$=14.99g,所以产率=$\frac{实际产量}{理论产量}$×100%=$\frac{10.895g}{14.99g}$×100%=72.7%;
故答案为:72.7%.
点评 本题以1-溴丁烷制备为背景,综合考查了物质的分离方法、实验装置、冷凝方法、转化率等,充分考查了学生分析、理解能力及解决实际问题的能力,本题难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 氯化氢 | B. | 乙醇 | C. | 碘 | D. | 氢氧化钠 |
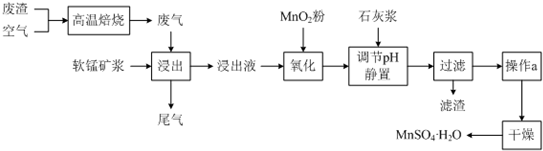
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(1)写出浸出过程中主要反应的化学方程式:SO2+MnO2=MnSO4.
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,并用pH试纸测定调节pH,pH应调节范围是4.7~8.3.
| A. | 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 | |
| B. | 逆反应速率减小,正反应速率增大,平衡向正反应方向移动 | |
| C. | 正、逆反应速率都减小,平衡向逆反应方向移动 | |
| D. | 正、逆反应速率都增大,平衡向正反应方向移动 |
 硫酸锰可作为饲料添加剂用于增肥,也可用于某些化学反应的催化剂,易溶于水,不溶于乙醇.工业上常用软锰矿(主要成分为MnO2,含有MgSO4等杂质)制备硫酸锰,其简化流程如下:
硫酸锰可作为饲料添加剂用于增肥,也可用于某些化学反应的催化剂,易溶于水,不溶于乙醇.工业上常用软锰矿(主要成分为MnO2,含有MgSO4等杂质)制备硫酸锰,其简化流程如下: