题目内容
7.已知下列两个有机反应:RCl+NaCN→RCN+NaCl;RCN+2H2O+HCl→RCOOH+NH4Cl现以乙烯为惟一有机原料(无机试剂及催化剂可任选),经过6步化学反应,合成二丙酸乙二醇脂(CH3CH2COOCH2CH2OOCCH2CH3),设计正确的合成路线,写出相应的化学方程式.
分析 根据二丙酸乙二醇脂(CH3CH2COOCH2CH2OOCCH2CH3)的结构简式可知,要合成二丙酸乙二醇脂(CH3CH2COOCH2CH2OOCCH2CH3),先要合成CH3CH2COOH和HOCH2CH2OH,再对比乙烯的结构简式可知,先将乙烯与氯化氢加成生成CH3CH2Cl,CH3CH2Cl与NaCN发生题中信息中的两步反应生成CH3CH2COOH,再用乙烯与氯气加成生成ClCH2CH2Cl,ClCH2CH2Cl发生碱性水解得HOCH2CH2OH,据此答题;
解答 解:根据二丙酸乙二醇脂(CH3CH2COOCH2CH2OOCCH2CH3)的结构简式可知,要合成二丙酸乙二醇脂(CH3CH2COOCH2CH2OOCCH2CH3),先要合成CH3CH2COOH和HOCH2CH2OH,再对比乙烯的结构简式可知,先将乙烯与氯化氢加成生成CH3CH2Cl,CH3CH2Cl与NaCN发生题中信息中的两步反应生成CH3CH2COOH,再用乙烯与氯气加成生成ClCH2CH2Cl,ClCH2CH2Cl发生碱性水解得HOCH2CH2OH,与发生酯化反应生成,相关的反应方程式为,CH2=CH2+HCl→CH3CH2Cl;CH3CH2Cl+NaCN→CH3CH2CN+NaCl;CH3CH2CN+2H2O+HCl→CH3CH2COOH+NH4Cl;CH2=CH2+Cl2→ClCH2CH2Cl;ClCH2CH2Cl+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaCl;2CH3CH2COOH+HOCH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$CH3CH2COOCH2CH2OOCCH2CH3+2H2O;
答:CH2=CH2+HCl→CH3CH2Cl;
CH3CH2Cl+NaCN→CH3CH2CN+NaCl;
CH3CH2CN+2H2O+HCl→CH3CH2COOH+NH4Cl;
CH2=CH2+Cl2→ClCH2CH2Cl;
ClCH2CH2Cl+2NaOH$→_{△}^{水}$HOCH2CH2OH+2NaCl;
2CH3CH2COOH+HOCH2CH2OH$→_{△}^{浓H_{2}SO_{4}}$CH3CH2COOCH2CH2OOCCH2CH3+2H2O.
点评 本题考查有机物推断与合成、有机反应类型、官能团的性质等,熟悉常见有机物的性质及反应类型是解题关键,注意运用逆推法和题中信息分析问题.

| A. | FeCl2(FeCl3)--加入足量铁粉,然后过滤,Fe+2FeCl3═3FeCl2 | |
| B. | NaCl(NaI)--加入适量氯水,用CCl4萃取分液,Cl2+2NaI═2NaCl+I2 | |
| C. | SiO2(Al2O3)--加入足量NaOH溶液,然后过滤,Al2O3+2NaOH═2NaAlO2+H2O | |
| D. | CaCl2(NH4Cl) 固体混合物--直接加热NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ |
| A. | 12 | B. | 32 | C. | 60 | D. | 80 |
| A. | 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O | |
| B. | 向漂白粉溶液中加入过量浓盐酸:ClO-+H+=HClO | |
| C. | “万能还原剂”NaBH4与水反应得到NaBO2:BH4-+2H2O=BO2-+4H2↑ | |
| D. | 向FeSO4溶液中加入Na2O2:2Na2O2+2Fe2++2H2O=4Na++2Fe(OH)2↓+O2↑ |

已知:某些氢氧化物沉淀的pH如表所示:
| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:适当升温、把硼镁泥粉碎或搅拌、或适当增加硫酸浓度.
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有SiO2、CaSO4.
(4)已知MgSO4、CaSO4的溶解度如表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为70%.(保留两位有效数字)
(6)金属镁可用于自然水体中铁件的电化学防腐,完成图2防腐示意图,并作相应标注
 和
和 .
. 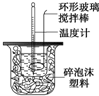 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在上图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L氢氧化钠溶液在上图装置中进行中和反应.在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:(1)环形玻璃搅拌棒的作用是使溶液上下混合均匀,保证溶液上下的温度达到一致.
(2)本实验中用稍过量的NaOH的原因教材中说是为保证盐酸完全被中和.试问:盐酸在反应中若因为有放热现象,而造成少量盐酸在反应中挥发,则测得的中和热偏小(填“偏大”“偏小”或“不变”).
(3)该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.?
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 30.6 | 5.5 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
(4)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会偏大(填“偏大”“偏小”或“不变”),其原因是用醋酸代替盐酸,醋酸电离要吸收能量,造成测得的中和热数值偏小,但中和热为负值,所以中和热偏大.?
| A. | 食醋除水垢 | B. | 硅胶作干燥剂 | ||
| C. | 漂白粉漂白织物 | D. | 铁粉作食品袋内的脱氧剂 |
 2C(g)+B(g)△H=+150akJ/mol.
2C(g)+B(g)△H=+150akJ/mol.