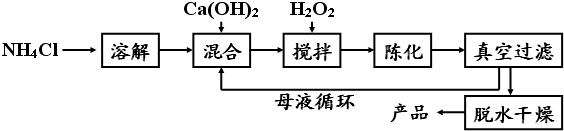
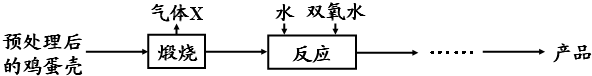
题目内容
1.向某密闭容器中加入0.15mol/L A、0.05mol/L C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示[t0时c( B)未画出,t1时增大到0.05mol/L].乙图为 t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况.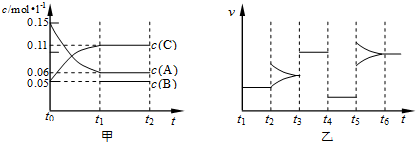
(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为0.02mol/L.
(2)若t5时改变的条件是升温,此时v(正)>v(逆),此反应正反应为吸热(填“吸热”或“放热”)反应.
(3)若 t1=15s,则t0~t1阶段以C 浓度变化表示的平均反应速率为v(C)=0.004mol/L•s.t3 时改变的某一反应条件可能是ab(选填序号).
a.使用催化剂 b.增大压强 c.增大反应物浓度 d.降低产物浓度
(4)若A的物质的量减少0.02mol时,容器与外界的热交换总量为a kJ,写出该反应的热化学方程式3A (g)
 2C(g)+B(g)△H=+150akJ/mol.
2C(g)+B(g)△H=+150akJ/mol.
分析 (1)若t4时改变的条件为减小压强,平衡不移动,说明反应前后气体的体积相等,图甲中t1时到达平衡,△c(A)=0.09mol/L,△c(C)=0.06mol/L,二者化学计量数之比为0.09:0.06=3:2,则B为生成物,反应方程式为:3A(g)?B(g)+2C(g),计算B的浓度变化量,B的起始浓度=B的平衡浓度-B的浓度变化量;
(2)若t5时改变的条件是升温,此时v(正)>v(逆),平衡正向移动,正反应为吸热反应;
(3)根据v=$\frac{△c}{△t}$计算v(C);t3 时改变条件瞬间正逆速率都增大,平衡不移动,反应前后气体体积不变,可能是增大压强,后使用催化剂;
(4)若A的物质的量减少0.02mol时,容器与外界的热交换总量为a kJ,则3mol A反应放出的吸收的热量为akJ×$\frac{3mol}{0.02mol}$=150kJ,注明物质聚集状态与反应热书写热化学方程式.
解答 解:(1)若t4时改变的条件为减小压强,平衡不移动,说明反应前后气体的体积相等,图甲中t1时到达平衡,△c(A)=0.09mol/L,△c(C)=0.06mol/L,二者化学计量数之比为0.09:0.06=3:2,则B为生成物,反应方程式为:3A(g)?B(g)+2C(g),则△c(B)=$\frac{1}{2}$△c(C)=0.03mol/L,B的起始浓度=0.05mol/L-0.03mol/L=0.02mol/L,故答案为:0.02;
(2)若t5时改变的条件是升温,此时v(正)>v(逆),平衡正向移动,正反应为吸热反应,故答案为:吸热;
(3)v(C)=$\frac{0.6mol/L}{15s}$=0.004mol/(L.s);t3 时改变条件瞬间正逆速率都增大,平衡不移动,反应前后气体体积不变,可能是增大压强,后使用催化剂,故答案为:0.004;ab;
(4)若A的物质的量减少0.02mol时,容器与外界的热交换总量为a kJ,则3mol A反应放出的吸收的热量为akJ×$\frac{3mol}{0.02mol}$=150kJ,反应热化学方程式为:3A (g)  2C(g)+B(g)△H=+150akJ/mol,
2C(g)+B(g)△H=+150akJ/mol,
故答案为:3A (g)  2C(g)+B(g)△H=+150akJ/mol.
2C(g)+B(g)△H=+150akJ/mol.
点评 本题考查化学平衡计算于影响因素、平衡图象、反应速率计算、热化学方程式书写等,关键是根据图象综合分析确定反应方程式,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 充入N2使压强增大可加快反应速率 | B. | A的平均反应速率为:0.4mol/(L•min) | ||
| C. | 平衡状态时B、C的反应速率相等 | D. | C的平均反应速率为:0.2mol/(L•min) |
| A. | Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c (H2S) | |
| B. | Na2C2O4溶液:c (OH-)=c(H+)+c(HC2O4-)+2c (H2C2O4) | |
| C. | Na2CO3溶液:c (Na+)+c (H+)=2c (CO32-)+c (OH-) | |
| D. | CH3COONa和CaCl2混合溶液:c (Na+)+c (Ca2+)=c (CH3COO-)+c (CH3COOH)+2c (Cl-) |
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
(2)b=4,x=27mL.
(3)反应③的离子方程式为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中
c(Ba2+)﹕c(OH-)=1:20;
(5)与NaHSO4相同,NaHSO3 和NaHCO3也为酸式盐.已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性.现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是ABC(填正确答案的标号).
A.c(Na+)>c(HRO${\;}_{3}^{-}$)>c(H+)>c(RO${\;}_{3}^{2-}$)>c(OH-)
B.c(Na+)+c(H+)=c(HRO${\;}_{3}^{-}$)+2c(RO${\;}_{3}^{2-}$)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO${\;}_{3}^{2-}$)+c(OH-)
D.两溶液中c(Na+)、c(HRO${\;}_{3}^{-}$)、c(RO${\;}_{3}^{2-}$)分别相等.
 不能氧化为氧化成醛或酸
不能氧化为氧化成醛或酸
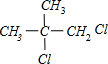 PMAA
PMAA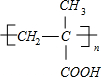
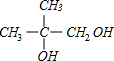 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2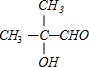 +2H2O;
+2H2O; $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O.